On se dira plus bon appétit, mais bonne chance !
Et oui, on ne les a pas arrêtés, et depuis le 3 janvier 2023, sans que les médias de masse ne vous en aient vraiment parlé, on nous donne à manger de la poudre d’insectes et de la pâte d’insectes.
Il n’y a pas d’indication spécifique (logo par exemple) sur les emballages ou dans les menus, il vous faut regarder produit par produit la liste des ingrédients et allergènes.
A priori en boulangerie, les pains tradition, la baguette et le pain classique ne sont pas concernés car soumis à une réglementation bien spécifique et plus drastique.
En revanche, les brioches, les viennoiseries, peuvent en avoir.

Exemple : un parent concerné pour ses enfants, déjeunant en cantines scolaires
» Aujourd’hui j’ai abordé la directrice de l’école de ma fille pour lui parler de l’acheta domesticus. Mon souci étant que ma fille mange à la cantine. Elle n’était pas au courant, je lui ai expliqué brièvement le topo et lui ai parlé des 2 rapports et des règlements d’exécution européens. Elle s’est sentie très concernée et m’a demandé sur quelles mentions elle devait être attentive sur les étiquettes … et qu’en plus elle avait beaucoup d’enfants allergiques aux fruits de mer et crustacés dans l’établissement. Elle m’a demandé de lui faire un mail avec tous ces éléments. En tout cas ce que j’en dis c’est qu’il faut aller voir les chefs d établissement pour les informer, ça peut être un excellent moyen d’action «
Autres situations
Restauration professionnelle (chez votre employeur, ou en restauration collective, restaurants et autres), vos achats en commerces dont boulangeries, les crèches, EHPAD etc. Partout où on mange, en fait
Actions
- prendre connaissance des informations ci-dessous
- imprimer les règlements
- vous adresser aux établissements scolaires de vos enfants, à vos commerces, etc., un modèle d’email est proposé plus loin dans cette page pour un premier contact ou formaliser vos points après un premier échange oral, ce qui est le mieux
Informations
Des protéines alternatives pour répondre aux défis démographiques et écologiques ! L’intention est louable sauf que le but est manqué ! Ces protéines ne sont quasiment pas digestes pour l’homme, donc dans ces conditions comment bénéficier des nutriments, et donc quelle utilité ? Les données scientifiques quant à la digestibilité (notamment liées à la chitine) et la biodisponibilité (proportion a atteindre la circulation sanguine) des protéines d’insectes sont absentes. Les risques sanitaires eux sont bien présents !




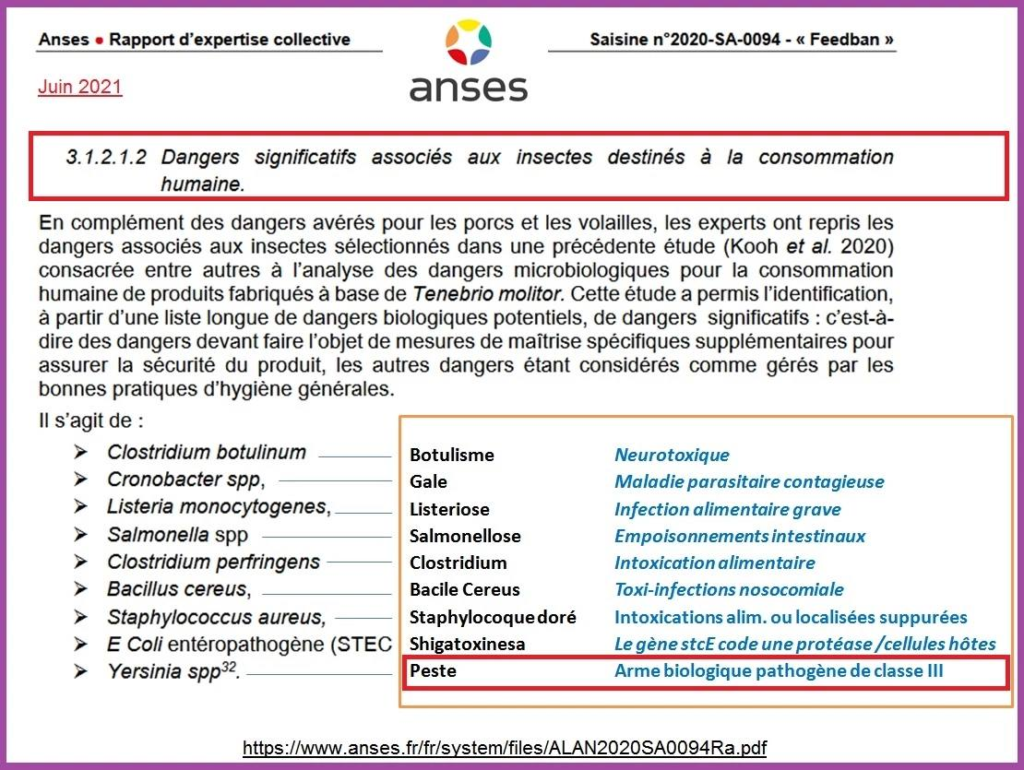
- Grillons d’Acheta Domesticus sous forme de poudre ou congelé ou séché ou partiellement dégraissé (Règlement d’Exécution de la commission RE 2023/5 et RE 2022/188)
- Alphitobius diaperinus (petit ténébrion mat) sous forme congelée, lyophilisée, en pâte et en poudre de larves (RE 2023/58)
Ces Règlements d’Exécution (RE) précisent tous le risque d’allergies (notamment chez les personnes déjà allergiques aux fruits de mers, crustacés et acariens), les risques d’anaphylaxie (pour acheta domesticus), les risques de déclenchement d’allergies primaires aux protéines d’acheta domesticus et d’alphitobius diaperinus petit ténébrion mat, les risques allergiques liés au substrat nourrissant les insectes (par exemple le gluten).

- les nouveaux aliments doivent être sûrs et qu’en cas d’incertitude le principe de précaution peut s’appliquer. Considérant 20 (Non respecté !)
- que les évaluations de sécurité devraient être réalisées par l’autorité européenne de sécurité des aliments. (et non par les producteurs eux-mêmes). Considérant 23 ( Non respecté !)
- que la commission ne doit autoriser que les nouveaux aliments ne présentant AUCUN RISQUE et qu’il n’y ait AUCUNE MODIFICATION DE LA VALEUR NUTRITIONNELLE OU DÉSAVANTAGE NUTRITIONNEL. Article 7 (Non respecté !)
- que c’est bien a l’autorité européenne de sécurité des aliments qu’il revient d’examiner la sécurité des aliments, avec au besoin des demandes complémentaires aux producteurs, et non l’inverse, de l’aveu même de la commission dans les RE ! Article 11 (Non respecté !)
CONCLUSION : Les RE relatifs à « acheta domesticus » et « petit ténébrion mat » ne remplissent pas les conditions fixées par l’Europe elle-même !
Sources et textes
Les « Considérants » : ce sont les chiffres entre parenthèse sur les RE : (1) (2) etc… et après viennent les articles
- RÈGLEMENT D’EXÉCUTION (UE) 2023/5 DE LA COMMISSION du 3 janvier 2023 autorisant la mise sur le marché de la poudre d’Acheta Domesticus : https://eur-lex.europa.eu/legal-content/FR/TXT/PDF/?uri=CELEX:32023R0005
- RÈGLEMENT D’EXÉCUTION (UE) 2023/58 DE LA COMMISSION du 5 janvier 2023 autorisant la mise sur le marché des formes congelée, lyophilisée, en pâte et en poudre de larves d’Alphitobius Diaperinus : https://eur-lex.europa.eu/legal-content/FR/TXT/PDF/?uri=CELEX:32023R0058
- RÈGLEMENT (UE) 2015/2283 DU PARLEMENT EUROPÉEN ET DU CONSEIL du 25 novembre 2015 relatif aux nouveaux aliments : https://eur-lex.europa.eu/legal-content/FR/TXT/PDF/?uri=CELEX:32015R2283
- AVIS de l’Anses relatif à « la valorisation des insectes dans l’alimentation et l’état des lieux des connaissances scientifiques sur les risques sanitaires en lien avec la consommation des insectes » : https://www.anses.fr/fr/content/avis-de-l’anses-relatif-à-la-valorisation-des-insectes-dans-l’alimentation-et-l’état-des
- Diversification de la ressource protéique en alimentation humaine et animale (Ministère de l’Agriculture et de la Souveraineté alimentaire) : https://agriculture.gouv.fr/diversification-de-la-ressource-proteique-en-alimentation-humaine-et-animale
Modèle d’email à adapter
Ce modèle est à adapter conformément à votre situation, et à remettre en page
A l’intention du Président du Conseil Régional,
A l’intention du Président du Conseil Départemental,
A l’intention du maire,
A l’intention du Chef d’Etablissement en charge de la gestion de la cantine scolaire,
A l’intention de la direction de structures d’accueil,
M / Mme ———————-
Votre adresse complète—–
————————————-
————————————-
————————————-
Fait à (votre ville) le (date d’envoi du courrier)
Objet :
– Règlementation européenne autorisant l’intégration d’insectes « Acheta domesticus » et « Alphatobius diapérinus » comme ingrédient alimentaire dans de nombreux produits destinés à l’ensemble de la population (Règlements d’exécution (UE) 2023/5 et 2023/58 de la commission)
– Risques liés aux protéines d’insectes indiqués dans les Règlements d’exécution (UE) 2023/5 et 2023/58 de la commission : anaphylaxie ; réactions allergiques (notamment chez les personnes déjà allergiques aux crustacés, fruits de mers et acariens en raison de la présence de chitine, constituant fondamental de l’exosquelette de la carapace des crustacés, des cuticules des acariens et des insectes) ; les risques de sensibilisation primaire aux protéines d’acheta domesticus et Alphatobius diapérinus ; les risques allergiques liés au substrat nourrissant les insectes.
– Votre Obligation de Sécurité pour les aliments proposés à la consommation dans le cadre des cantines scolaires ainsi que d’autres structures d’accueil (crèches, Ehpad, centre de loisirs…)
Madame, Monsieur,
Choisir le cas qui correspond à votre situation et supprimer les autres cas :
*Mon (ou mes) enfant est scolarisé à (nom de l’établissement + ville de l’établissement) et mange à la cantine.
*Mon enfant fréquente la crèche (nom de la crèche + ville) et y prend ses repas.
*Mon (ou mes) enfant fréquente le centre de loisirs de (nom du centre loisirs + ville du centre de loisirs) et y prend ses repas
*Mon enfant (ou mes) est scolarisé à (nom de l’établissement + ville de l’établissement) et mange à la cantine et dispose d’un PAI (Projet d’Accueil Personnalisé) pour allergie.
*Mon parent réside en Ehpad (nom de l’Ehpad + ville) et y prend tous ses repas.
*Autre cas : libre à vous.
Par règlements d’exécution, la Commission Européenne a autorisé les 3 et 5 janvier 2023 l’intégration d’insectes « Acheta domesticus » et « Alphatobius diapérinus (petit ténébrion mat) » comme ingrédient alimentaire intégrés dans de nombreux produits destinés à l’ensemble de la population, sous formes de poudre partiellement dégraissée, poudre, congelée, lyophilisée, pâte et poudre de larves. Ci-après les règlements d’exécution 2023/ 5 (acheta domesticus) et 2023/58 (Alphitobius diaperinus) de la commission :
https://eur-lex.europa.eu/legal-content/FR/TXT/PDF/?uri=CELEX:32023R0005
https://eur-lex.europa.eu/legal-content/FR/TXT/PDF/?uri=CELEX:32023R0058&from=EN
L’ajout de ces protéines dites alternatives, pour répondre aux défis démographiques et écologiques semblent à première vue louable dans les intentions.
Cependant, ce but est manqué car l’intérêt nutritionnel fait ici défaut. Ces protéines ne sont quasiment pas digestes pour l’homme, donc dans ces conditions comment bénéficier des nutriments ? Les données scientifiques quant à la digestibilité (notamment liées à la présence de chitine) et la biodisponibilité (proportion à atteindre la circulation sanguine) des protéines d’insectes sont absentes.
Les risques sanitaires quant à eux sont bien présents.
Pour votre parfaite information, veuillez noter :
– Qu’en 2014 , L’ANSES s’était auto-saisie (saisine n° 2014 –SA -0153) et a rendu un rapport le 12 février 2015 relatif à « la valorisation des insectes dans l’alimentation et l’état des lieux des connaissances scientifiques sur les risques sanitaires en lien avec la consommation des insectes. Le paragraphe 4.3. Analyse des dangers liés à la consommation des insectes (page 16 à 28) fait un état détaillé des risques sanitaires :
https://www.anses.fr/fr/system/files/BIORISK2014sa0153.pdf
– Qu’en 2018, le ministère de l’agriculture a commandé un rapport au CGAAER (Conseil Général de l’Alimentation de l’Agriculture et des Espaces Ruraux). La motivation substantielle de la commande de ce rapport résidant dans le développement des protéines alternatives. Le rapport du CGAAER a été rendu en avril 2019 sous le n° 18079. Il a rappelé les risques pointés par l’ANSES ainsi que les doutes sur l’intérêt nutritionnel des protéines d’insectes : faible digestibilité, et présence de facteurs anti-nutritionnels. Le paragraphe 3.1 et 3.1.1 y font expressément référence (Pages 16 et 17).
– Qu’ à ce jour, l’Europe n’est pas proactive sur les données scientifiques et de sécurité puisqu’elle s’en remet purement et simplement aux données fournies par les producteurs eux-mêmes. En effet, l’Autorité européenne de sécurité des aliments reconnait formellement dans ses avis scientifiques se baser uniquement sur les données transmises par les producteurs ( a) et disposer de « données limitées » nécessitant de poursuivre les recherches (b).
(a) L’Autorité s’en remet uniquement aux données scientifiques et de sécurité du producteur (demandeur)
C’est ainsi que dans le considérant (12) du règlement d’exécution 2023/58, l’Autorité de sécurité des aliments reconnait s’en remettre au producteur :
« (12) Dans son avis scientifique, l’Autorité a aussi indiqué que ses conclusions sur l’innocuité du nouvel aliment étaient fondées sur les données analytiques sur la composition du nouvel aliment, les études de stabilité sur le nouvel aliment, l’étude in vitro sur la digestibilité des protéines et l’étude de toxicité subchronique sur 90 jours qui figurent dans le dossier du demandeur et sans lesquelles elle n’aurait pu évaluer le nouvel aliment et aboutir à ces conclusions. »
Il en est de même dans le considérant (11) du règlement d’exécution 2023/5 :
« (11) Dans son avis scientifique, l’Autorité a aussi indiqué que ses conclusions sur l’innocuité de la poudre d’Acheta domesticus (grillons domestiques) partiellement dégraissés étaient fondées sur les données et études scientifiques, à savoir la description détaillée du procédé de production, les résultats des analyses immédiates, les données analytiques sur les contaminants, les résultats des études de stabilité, les données analytiques sur les paramètres microbiologiques et les résultats des études sur la digestibilité des protéines, qui figurent dans le dossier du demandeur et sans lesquelles elle n’aurait pu évaluer le nouvel aliment et aboutir à ces conclusions »
(b) L’Autorité reconnait disposer de données limitées
C’est ainsi que dans le considérant (8) du règlement d’exécution 2023/5, l’Autorité de sécurité des aliments reconnait disposer de données limitées : «(8) Dans son avis scientifique, l’Autorité a conclu, sur la base de données limitées publiées sur les allergies alimentaires liées aux insectes en général, qui lient de manière équivoque la consommation d’Acheta domesticus à un certain nombre de cas d’anaphylaxie, et sur la base d’éléments démontrant qu’Acheta domesticus contient plusieurs protéines potentiellement allergènes, que la consommation de ce nouvel aliment pouvait déclencher une sensibilisation aux protéines d’Acheta domesticus. Elle a recommandé de poursuivre les recherches sur l’allergénicité d’Acheta domesticus »
Il en est de même dans le considérant (8) du règlement d’exécution 2023/58 : (8) Dans son avis scientifique, l’Autorité a aussi conclu, sur la base de données limitées publiées sur les allergies alimentaires liées aux insectes, que la consommation du nouvel aliment pouvait entraîner une sensibilisation primaire et des réactions allergiques aux protéines des larves du petit ténébrion mat. Elle a recommandé de poursuivre les recherches sur l’allergénicité des larves d’Alphitobius diaperinus
– Que les règlements d’exécution 2023/5 et 2023/58 indiquent tous deux les risques d’allergies, notamment chez les personnes déjà allergiques aux fruits de mers, crustacés, acariens, les risque d’anaphylaxie (pour acheta domesticus), les risques de déclenchement d’allergies primaires aux protéines d’acheta domesticus et d’alphitobius diapérinus, les risques liés au substrat nourrissant les insectes(On peut penser au gluten).
Il semble ici utile de vous rappeler l’ Obligation de Sécurité quant aux aliments proposés à la consommation dans le cadre des cantines scolaires et des autres structures d’accueil , pour laquelle la responsabilité vous incombe, et de prendre toutes les mesures nécessaires destinées à protéger les élèves, collégiens, lycéens ET ce qu’ils disposent d’un PAI (Projet d’accueil Personnalisé) ou pas puisque cette obligation est une obligation de sécurité générale qui vise tous les publics, afin de contrôler que lesdits produits à base d’insectes soient purement et simplement écartés des cantines et salles de repas de ces publics. Il en va de même pour toutes les autres structures d’accueils tels que les crèches, centres de loisirs, ehpad et toutes autres structures pour lesquelles votre responsabilité vous engage.
Enfin, veuillez noter que le règlement UE 2015/ 2283 du parlement européen et du conseil du 25 novembre 2015 relatif à la mise sur le marché européen des nouveaux aliments, n’a pas été respecté :
EUR-Lex – 32015R2283 – EN – EUR-Lex (europa.eu)
Ce texte prévoit :
– Que Les nouveaux aliments doivent être sûrs et que, en cas d’incertitude, le principe de précaution peut s’appliquer. Le considérant (20) n’est pas respecté : « (20) Les nouveaux aliments ne devraient être autorisés et utilisés que s’ils répondent aux critères fixés dans le présent règlement. Les nouveaux aliments devraient être sûrs, et si leur sécurité ne peut être évaluée et qu’une incertitude scientifique persiste, le principe de précaution peut s’appliquer. Leur utilisation ne devrait pas induire le consommateur en erreur. Par conséquent, lorsqu’un nouvel aliment est destiné à remplacer une autre denrée alimentaire, il ne devrait pas différer de cette denrée d’une manière qui soit désavantageuse pour le consommateur sur le plan nutritionnel. »
– Que les évaluations de sécurité devraient être réalisées par l’Autorité européenne de sécurité des aliments (et non par les producteurs eux-mêmes). Le considérant 23 n’est pas respecté : « (23) Il y a également lieu de définir clairement les critères d’évaluation des risques en matière de sécurité liés aux nouveaux aliments et de fixer ces critères. Afin de garantir que les nouveaux aliments sont soumis à des évaluations scientifiques harmonisées, ces évaluations devraient être réalisées par l’Autorité européenne de sécurité des aliments (ci-après dénommée «Autorité»). Dans le cadre de la procédure d’autorisation d’un nouvel aliment et de mise à jour de la liste de l’Union, il y a lieu de demander à l’Autorité de rendre un avis lorsque la mise à jour est susceptible d’avoir un effet sur la santé humaine. Dans son avis, l’Autorité devrait évaluer toutes les caractéristiques du nouvel aliment susceptibles de présenter un risque en matière de sécurité pour la santé humaine et tenir compte des effets possibles sur les groupes vulnérables de la population. Lorsqu’un aliment nouveau se compose de nanomatériaux manufacturés, l’Autorité devrait notamment vérifier que les méthodes d’essai les plus récentes sont employées pour évaluer leur sécurité. »
De même d’ailleurs que l’article 11 qui n’est pas respecté, c’est à l’Autorité d’examiner la sécurité, avec au besoin des demandes complémentaires au producteur (demandeur) : Article 11 – Avis de l’Autorité –
1. Lorsque la Commission sollicite l’avis de l’Autorité, elle lui transmet la demande valable sans retard, et au plus tard un mois après avoir vérifié sa validité. L’Autorité adopte son avis dans un délai de neuf mois à compter de la date de réception d’une demande valable.
2. Lors de l’évaluation de la sécurité d’un nouvel aliment, l’Autorité examine, le cas échéant: a) si le nouvel aliment concerné est aussi sûr qu’une denrée alimentaire d’une catégorie d’aliments comparable déjà mise sur le marché dans l’Union; b) si la composition du nouvel aliment et ses conditions d’utilisation ne présentent aucun risque en matière de sécurité pour la santé humaine dans l’Union; c) si un nouvel aliment destiné à remplacer un autre aliment ne diffère pas de cet aliment d’une manière telle que sa consommation normale serait désavantageuse pour le consommateur sur le plan nutritionnel.
3. L’Autorité transmet son avis à la Commission, aux États membres et, le cas échéant, au demandeur.
4. Dans des cas dûment justifiés, lorsque l’Autorité sollicite des informations complémentaires auprès du demandeur, le délai de neuf mois prévu au paragraphe 1 peut être prolongé. Après consultation du demandeur, l’Autorité fixe le délai dans lequel ces informations complémentaires doivent être fournies et en informe la Commission. Si la Commission ne fait pas objection à cette prolongation dans les huit jours ouvrables suivant l’information faite par l’Autorité, le délai de neuf mois prévu au paragraphe 1 est automatiquement prolongé de la durée du délai supplémentaire. La Commission informe les États membres de cette prolongation.
5. Lorsque les informations complémentaires visées au paragraphe 4 ne lui sont pas fournies dans le délai supplémentaire visé audit paragraphe, l’Autorité élabore son avis sur la base des informations disponibles.
6. Lorsqu’un demandeur fournit des informations complémentaires de sa propre initiative, il transmet ces informations à l’Autorité. Dans ce cas, l’Autorité rend son avis dans le délai de neuf mois prévu au paragraphe 1.
7. L’Autorité met les informations complémentaires communiquées conformément aux paragraphes 4 et 6 à la disposition de la Commission et des États membres.
– Que la commission ne doit autoriser que les nouveaux aliments ne présentant aucun risque et qu’il n’y ait aucune modification de la valeur nutritionnelle ou de désavantage nutritionnel. L’article 7 n’est pas respecté, les 3 conditions (cumulatives) ne sont ni réunies ni respectées : Article 7- Conditions générales à remplir pour l’inscription de nouveaux aliments sur la liste de l’Union – La Commission n’autorise et n’inscrit un nouvel aliment sur la liste de l’Union que s’il remplit les conditions suivantes:
a) l’aliment ne présente aucun risque en matière de sécurité pour la santé humaine, compte tenu des données scientifiques disponibles;
b) l’utilisation prévue de l’aliment n’induit pas le consommateur en erreur, surtout lorsque l’aliment est destiné à en remplacer un autre et qu’une modification importante est apportée à la valeur nutritionnelle;
c) lorsque l’aliment est destiné à remplacer un autre aliment, le nouvel aliment ne diffère pas de cet autre aliment d’une manière telle que sa consommation normale serait désavantageuse pour le consommateur sur le plan nutritionnel.
Votre Responsabilité demeure donc pleine et entière quant à l’obligation de sécurité liée aux aliments proposés à la consommation dans les cantines scolaires et autres salles de repas.
Par conséquent, nous demandons expressément qu’aucun produit alimentaire comprenant lesdits insectes visés actuels, ou futurs qui seraient imposés dans les mêmes conditions, ne soient proposés dans ces lieux ainsi que leur retrait immédiat si ils y sont déjà présents !
Espérant compter sur votre bon sens et votre coopération sur ce sujet majeur, bien préférable à la voie judiciaire. Il semble permis de pouvoir s’entendre et de débattre sur ce sujet important de l’alimentation qui a surgi sans aucune concertation ni communication, pour vous comme pour la population de façon générale.
Dans l’attente de votre retour, veuillez agréer, l’expression de nos sincères salutations.
Source : https://telegra.ph/Insectes-dans-lassiette-02-09
Les insectes comestibles et leur rôle dans la transmission des maladies parasitaires à l’homme

Le 1er janvier 2018 est entré en vigueur le règlement (UE) 2015/2238 du Parlement européen et du Conseil du 25 novembre 2015, introduisant la notion de « nouveaux aliments », y compris les insectes et leurs parties.
Parmi les espèces d’insectes les plus couramment utilisées, on trouve : les vers de farine ( Tenebrio molitor ), les grillons domestiques ( Acheta domesticus ), les blattes (Blattodea) et les criquets migrateurs ( Locusta migrans)). Dans ce contexte, la question insondable est le rôle des insectes comestibles dans la transmission des maladies parasitaires qui peuvent causer des pertes importantes dans leur élevage et peuvent constituer une menace pour les humains et les animaux.Le but de cette étude était d’identifier et d’évaluer les formes de développement des parasites colonisant les insectes comestibles dans les fermes familiales et les animaleries en Europe centrale et de déterminer le risque potentiel d’infections parasitaires pour les humains et les animaux. Le matériel expérimental comprenait des échantillons d’insectes vivants provenant de 300 fermes familiales et animaleries, dont 75 fermes de vers de farine, 75 fermes de grillons domestiques, 75 fermes de cafards siffleurs de Madagascar et 75 fermes de criquets migrateurs.
Des parasites ont été détectés dans 244 (81,33 %) des 300 (100 %) élevages d’insectes examinés. Dans 206 (68,67%) des cas, les parasites identifiés étaient pathogènes pour les insectes uniquement ; dans 106 (35,33 %) cas, les parasites étaient potentiellement parasitaires pour les animaux ; et dans 91 (30,33 %) cas, les parasites étaient potentiellement pathogènes pour l’homme.
Les insectes comestibles sont un réservoir sous-estimé de parasites humains et animaux. Nos recherches indiquent le rôle important de ces insectes dans l’épidémiologie des parasites pathogènes des vertébrés. L’examen parasitologique conduit suggère que les insectes comestibles peuvent être le vecteur de parasites le plus important pour les animaux domestiques insectivores.
Selon nos études, les recherches futures devraient se concentrer sur la nécessité d’une surveillance constante des élevages d’insectes étudiés pour les agents pathogènes, augmentant ainsi la sécurité des denrées alimentaires et des aliments pour animaux. Les insectes comestibles sont un réservoir sous-estimé de parasites humains et animaux.
Nos recherches indiquent le rôle important de ces insectes dans l’épidémiologie des parasites pathogènes des vertébrés. L’examen parasitologique conduit suggère que les insectes comestibles peuvent être le vecteur de parasites le plus important pour les animaux domestiques insectivores. Selon nos études, les recherches futures devraient se concentrer sur la nécessité d’une surveillance constante des élevages d’insectes étudiés pour les agents pathogènes, augmentant ainsi la sécurité des denrées alimentaires et des aliments pour animaux. Les insectes comestibles sont un réservoir sous-estimé de parasites humains et animaux.
Nos recherches indiquent le rôle important de ces insectes dans l’épidémiologie des parasites pathogènes des vertébrés. L’examen parasitologique conduit suggère que les insectes comestibles peuvent être le vecteur de parasites le plus important pour les animaux domestiques insectivores. Selon nos études, les recherches futures devraient se concentrer sur la nécessité d’une surveillance constante des élevages d’insectes étudiés pour les agents pathogènes, augmentant ainsi la sécurité des denrées alimentaires et des aliments pour animaux.
Introduction
La demande croissante d’aliments faciles à digérer et nutritifs a contribué à l’émergence de nouvelles sources alimentaires dans la transformation agricole. Les insectes comestibles font partie de ces catégories d’aliments sous-utilisés à haute valeur nutritionnelle.
Les insectes sont élevés pour la consommation directe et pour être utilisés dans la production de denrées alimentaires et d’aliments pour animaux. Le concept de « nouveaux aliments », y compris les insectes et leurs parties, a été introduit par le règlement (UE) 2015/2238 du Parlement européen et du Conseil du 25 novembre 2015 relatif aux nouveaux aliments, entré en vigueur le 1er janvier 2018. La popularité croissante des animaux de compagnie exotiques a également accru la demande de nouveaux aliments.
Cependant, les insectes comestibles sont souvent infectés par des agents pathogènes et des parasites qui entraînent des pertes de production importantes. Ces agents pathogènes constituent également une menace indirecte pour les humains, le bétail et les animaux exotiques. La majorité des entreprises d’élevage d’insectes dans le monde sont des entreprises familiales et, en Europe, les insectes comestibles sont rarement produits à grande échelle.
Dans l’Union européenne, l’entomophagie est rare et considérée comme un tabou culturel. Plus de 1900 espèces d’insectes sont considérées comme comestibles. Les insectes comestibles les plus populaires sont les vers de farine ( Tenebrio molitor ), les grillons domestiques ( Acheta domesticus ), les blattes ( Blattodea ) et les criquets migrateurs ( Locusta migrans ).
Les vers de farine sont des coléoptères de la famille des Tenebrionidae. Les coléoptères adultes mesurent généralement de 13 à 20 mm de long et les larves ont une longueur d’environ 30 mm. Au cours de leur court cycle de vie de 1 à 2 mois, les femelles pondent environ 500 œufs. L’un des plus grands fournisseurs de vers de farine au monde est HaoCheng Mealworm Inc. qui produit 50 tonnes d’insectes vivants par mois et exporte 200 000 tonnes d’insectes séchés par an [ 7 ] .
Les vers de farine sont utilisés dans l’alimentation humaine et animale et constituent une source de nourriture populaire pour les animaux de compagnie exotiques, notamment les reptiles et les insectivores. La valeur nutritionnelle des larves de vers de farine est comparable à celle de la viande et des œufs de poule. Les vers de farine sont faciles à stocker et à transporter. Ils sont riches en nutriments hautement disponibles et sont considérés comme une source d’alimentation très prometteuse pour l’élevage de volailles et de poissons. Les vers de farine peuvent également être administrés aux animaux de compagnie et au bétail.
La popularité de la consommation de vers de farine par les humains est à la hausse, en particulier en Europe. Les vers de farine dégradent efficacement les déchets biologiques et la mousse de polystyrène. Les parasites de vers de farine les plus courants comprennent Gregarine spp., Hymenolepis diminuta et les acariens de la famille des Acaridae. Les vers de farine sont des insectes modèles dans la recherche parasitologique.
Le grillon domestique ( A. domesticus ) a une longueur allant jusqu’à 19 mm et son cycle de vie s’étend sur 2 à 3 mois. C’est une source de nourriture pour les reptiles, les amphibiens et les arachnides élevés en captivité, y compris les araignées de la famille des Theraphosidae. Les grillons domestiques sont consommés par l’homme sous forme de poudre ou d’extraits protéiques. Les grillons entiers sont consommés directement en Thaïlande [ 1 ]. Ces insectes sont fréquemment infestés par Nosema spp., Gregarine spp. et Steinernema spp.
Les blattes de l’ordre Blattodea comprennent la blatte germanique ( Blattella germanica ), la blatte américaine ( Periplaneta americana ), la blatte fouisseuse cubaine ( Byrsotria fumigata ), la blatte sifflante de Madagascar ( Gromphadorhina portentosa ), la blatte mouchetée ( Nauphoeta cinerea ), la blatte du Turkestan ( Shelfordella lateralis ) et la blatte orientale ( Blatta orientalis ). Les cafards peuvent vivre jusqu’à 12 mois et les plus gros individus atteignent jusqu’à 8 cm de long. Les cafards sont de plus en plus populaires dans l’alimentation humaine et font partie de la cuisine locale dans diverses régions du monde.
Les criquets migrateurs appartiennent à la famille des Acrididae, ordre des Orthoptères. Les insectes mesurent jusqu’à 9 cm de long et vivent jusqu’à 3 mois. Les criquets sont consommés par les amphibiens, les reptiles et les humains, principalement en Afrique et en Asie. Les criquets contiennent jusqu’à 28 % de protéines et 11,5 % de matières grasses, dont jusqu’à 54 % de graisses insaturées. Nosema spp. et Gregarine spp. sont les parasites acridiens les plus répandus.
Le but de cette étude était d’identifier et d’évaluer les formes de développement des parasites colonisant les insectes comestibles dans les fermes familiales et les animaleries en Europe centrale et de déterminer le risque potentiel d’infections parasitaires pour les humains et les animaux.
Résultats
Prévalence
Des formes parasitaires de développement ont été détectées dans 244 (81,33%) des 300 (100%) élevages d’insectes examinés. Dans 206 (68,67%) des cas, les parasites identifiés étaient pathogènes pour les insectes uniquement ; dans 106 (35,33 %) cas, les parasites étaient potentiellement parasitaires pour les animaux ; et dans 91 (30,33 %) cas, les parasites étaient potentiellement pathogènes pour l’homme. Nosema spp. des spores ont été détectées dans 27 (36,00%) élevages de criquets et 35 (46,67%) élevages de criquets.
La présence de Cryptosporidium spp. a été observée dans 12 (16%) élevages de vers de farine, 5 (6,67%) élevages de criquets, 13 (17,33%) élevages de blattes et 4 (5,33%) élevages de criquets. Quarante-quatre (58,67%) élevages de vers de farine, 30 (40,00%) élevages de criquets, 57 (76%) élevages de blattes et 51 (68,00%) élevages de criquets étaient infestés par Gregarine spp., dontSteganorhynchus dunwodyii , Hoplorhynchus acanthatholius , Blabericola haasi , Gregarina blattarum , G. niphadrones , Gregarina cuneata et Gregarina polymorpha . Isospora spp. ont été détectés dans 7 (9,33%) élevages de vers de farine, 4 (5,33%) élevages de criquets, 9 (12,00%) élevages de blattes et 8 (10,67%) élevages de criquets. Onze (14,67%) élevages de vers de farine, 13 (17,33%) élevages de blattes et 9 (12,00%) élevages de criquets étaient infestés par Balantidium spp. y compris B. coli et B. blattarum . La présence d’ Entamoeba spp., dont E. coli ,E. dispar , E. hartmanii et E. histolytica , ont été détectés dans 9 (12%) élevages de vers de farine, 14 (18,67%) élevages de blattes et 4 (5,33%) élevages de criquets. Dix-sept (22,67 %) élevages de blattes ont été colonisés par Nyctotherus spp., dont N. ovalis et N. periplanetae . Des cysticercoïdes de ténias, y compris Hymenolepis nana , H. diminuta et Raillietina spp., ont été détectés dans 9 (12 %) élevages de vers de farine, 3 (4 %) élevages de grillons, 4 (5,33 %) élevages de blattes et 3 (4,00 %) élevages de criquets. Les nématodes de l’ordre Gordiidea ont colonisé 6 (8,00%) élevages de grillons et criquets. Hammerschmidtiella diesignia été détecté dans 35 (46,67%) élevages de blattes. Steinernema spp. a été identifié dans 22 (29,33%) élevages de criquets, et Pharyngodon spp.—dans 14 (18,67%) élevages de criquets. La présence de Physaloptera spp. a été observé dans 4 (5,4%) élevages de vers de farine, 2 (2,67%) élevages de criquets, 9 (12,00%) élevages de blattes et 7 (9,33%) élevages de criquets. Cinq (6,67%) élevages de vers de farine et 7 (9,33%) élevages de blattes étaient infestés par Spiruroidea. Thelastomidés spp. a été détecté dans 10 (13,33%) élevages de criquets et criquets. Thélastomespp. a été identifié dans 58 (77,33%) élevages de blattes. Des acanthocéphales ont été observés dans 2 (2,67%) élevages de vers de farine et 3 (4,00%) élevages de blattes. Deux élevages de blattes (2,67 %) étaient infestés de Pentastomida. La présence d’Acaridae, dont les acariens, a été observée dans 35 (46,67%) élevages de vers de farine, 15 (20,00%) élevages de blattes et 7 (9,33%) élevages de criquets. Dans le groupe d’échantillons prélevés dans les élevages de vers de farine, Cryptosporidium spp. ont été notés dans 37 (12,33%) échantillons, Gregarine spp. ont été détectés dans 99 (33,00 %) échantillons, Isospora spp. — dans 12 (4 %) échantillons, Entamoeba spp. — dans 12 (4,00 %) échantillons, Balantidium spp. — dans 14 (4,67 %) échantillons, cysticercoïdes — dans 18 (6.00%) échantillons, Pharyngodonspp.—dans 10 (3 %) des échantillons, Physaloptera spp.—dans 15 (5,00 %) échantillons, Spiruroidea —dans 6 (2,00 %) échantillons, Acanthocephala spp.—dans 2 (0,67 %) et Acaridae dans 80 ( 26,67 %) échantillons. Dans le groupe d’échantillons prélevés dans les élevages de grillons, Nosema spp. ont été identifiés dans 74 (24,67 %) échantillons, Cryptosporidium spp. — dans 5 (1,67 %) échantillons Isospora spp. — dans 8 (2,67 %) échantillons, Gregarine spp. — dans 72 (24,00 %) échantillons, cysticercoïdes — dans 4 ( 1,33 %) échantillons, Physaloptera spp.—dans 4 (1,33 %) échantillons, Steinernemaspp.—dans 11 (3,67%) échantillons, et nématodes de l’ordre Gordiidea—dans 19 (6,33%) échantillons. Dans le groupe d’échantillons provenant d’élevages de blattes, la présence de Cryptosporidium spp. a été déterminée dans 89 (11,87%) échantillons, Gregarine spp.—dans 236 (31,47%) échantillons, Isospora spp.—dans 16 (2,13%) échantillons, Nyctotherus spp.—dans 57 (7,60%) échantillons, Entamoeba spp.— dans 34 (4,53 %) échantillons, Balantidium spp. — dans 35 (4,67 %) échantillons, cysticercoïdes — dans 4 (0,53 %) échantillons, Pharyngodon spp. — dans 20 (2,67 %) échantillons, Physaloptera spp. — dans 23 (3,07 %) échantillons %) échantillons, Spiruroidea—dans 14 (1,87%) échantillons, Thelastoma spp.—dans 270 (36,00%) échantillons,H. diesigni — dans 143 (19,07 %) échantillons, Acanthocephala spp. — dans 5 (0,67 %) échantillons, Pentastomida spp. — dans 5 (0,67 %) échantillons, et Acaridae — dans 29 (3,87 %) échantillons. Les parasites suivants ont été identifiés dans les élevages acridiens : Nosema spp.—dans 125 (16,67%) échantillons, Cryptosporidium spp.—dans 13 (1,73%) échantillons, Gregarine spp.—dans 180 (24,00%) échantillons, Isospora spp.—dans 15 (2,00 %) échantillons, Entamoeba spp. dans 9 (1,20 %) échantillons, Balantidium spp. — dans 14 (1,87 %) échantillons, cysticercoïdes — dans 15 (2,00 %) échantillons, Physaloptera spp. — dans 17 (2,27 %) échantillons, Steinernemaspp.—dans 31 (4,13%) échantillons, nématodes de l’ordre Gordiidea—dans 7 (0,93%) échantillons, et Acaridae—dans 31 (4,13%) échantillons. Les résultats détaillés de l’examen parasitologique ont été mis en Tableau 1.
Tableau 1
Type / Espèce et formes de développement des parasites trouvés chez les insectes examinés dans les échantillons collectifs / individuels examinés en fonction du lieu de détection.
| Parasite (formes de développement) | Coléoptère du ver de farine | Grillon domestique | Cafard sifflant de Madagascar | Criquet migrateur | ||||
|---|---|---|---|---|---|---|---|---|
| gt | rb | gt | rb | gt | rb | gt | rb | |
| Nosema spp. (spores) | – | – | 74 | – | – | – | 125 | – |
| Cryptosporidium spp. (oocystes) | 31 | dix | 5 | 2 | 57 | 35 | 13 | 4 |
| Grégarine spp. (oocystes, sporozoïtes) | 99 | – | 72 | – | 236 | – | 180 | – |
| Isospora spp. (oocystes) | 3 | 12 | 1 | 8 | 6 | 16 | 1 | 15 |
| Balantidium spp. (amibe, kystes) | 1 | 14 | – | – | 29 | 8 | 5 | 14 |
| Entamoeba spp. (amibe, kystes) | 3 | 11 | – | – | 30 | 7 | 1 | 9 |
| Nyctotherus spp. (amibe, kystes) | – | – | – | – | 57 | 2 | – | – |
| Cestodes (œufs, cysticercoïdes) | 8 | 22 | – | 4 | 3 | 4 | 2 | 15 |
| Gordiidae spp (kystes, juvéniles) | – | – | – | 19 | – | – | 16 | – |
| H. diessigni (formes adultes, œufs) | – | – | – | – | 143 | – | – | – |
| Pharyngodon spp. (larves L3) | – | 13 | – | – | – | 22 | – | – |
| Physaloptera spp. (larves L3) | – | 19 | – | 4 | – | 42 | – | 17 |
| Spiruroidea (larves L3) | – | 8 | – | – | – | 14 | – | – |
| Thelastomatidae (formes adultes, œufs) | – | – | 47 | – | – | – | 31 | – |
| Steinernema spp. (formes adultes) | – | – | – | 11 | – | – | – | 17 |
| Thelastoma spp. (formes adultes, œufs) | – | – | – | – | 270 | – | – | – |
| Acanthocephala spp. (cystacanthes) | – | 2 | – | – | – | 5 | – | – |
| Pentastomides (nymphes) | – | – | – | – | – | 5 | – | – |
| Acaridae (œufs, nymphes, formes adultes) | 4 | 80 | – | – | 2 | 29 | 1 | 31 |
gt—tractus gastro-intestinal ; rb—reste du corps
Probabilité d’apparition du parasite
Le risque d’infections à Cestoda, Acanthocephala et Acaridae était significativement plus élevé chez les insectes importés d’Afrique et d’Asie que chez les insectes achetés auprès de fournisseurs européens. Les élevages dont le cheptel était complété par des insectes provenant d’autres élevages étaient plus fréquemment colonisés par Nosema spp., Isospora spp., Cryptosporidium spp., Entamoeba spp., Cestoda, Pharyngodon spp., Gordius spp., Physaloptera spp., Thelastoma spp. et H. diesigni que les fermes fermées. Le risque d’infection par Cryprosporidium spp., Gregarine spp, Balantidium spp,Entamoeba spp., Steinernema spp., Gordiidea, H. diesigni et Acaridae étaient plus élevés chez les insectes nourris avec des déchets de cuisine et des sources d’alimentation collectées localement que chez les insectes nourris uniquement avec des produits frais ou des aliments spécialisés. Les insectes qui sont entrés en contact direct ou indirect avec des animaux présentaient un risque plus élevé d’exposition à Isospora spp., Cryptosporidium spp., Cestoda, Pharyngodon spp., Physaloptera spp., Thelastoma spp. et H. diessigni , mais à moindre risque d’exposition à Nyctotherus spp. Les résultats statistiquement significatifs de la régression logistique ont été placés dans Tableau 2.
Tableau 2
Modèle de régression logistique, montrant des relations statistiquement significatives entre les espèces de parasites et l’origine des insectes, le système de rotation des stocks d’insectes, le type d’alimentation et le contact avec les animaux.
| Nosema spp. | rotation | <0,000001 | 2.28 | 0,18 | 33,99 | <0,000001 | 2,90 | 2.03-4.14 |
| Isospora spp. | rotation | 0,000043 | 28,88 | 0,31 | 10h45 | 0,0012 | 2,74 | 1.49-5.06 |
| animaux | 12.03 | 0,32 | 3,95 | 0,047 | 1,87 | 1.01-3.48 | ||
| Cryprosporidium spp. | rotation | 0,00001 | 14.54 | 0,22 | 15.53 | 0,00002 | 5.11 | 1.03-14.65 |
| alimentation | 17.76 | 0,19 | 19.22 | 0,0013 | 10.21 | 0,81-6,45 | ||
| animaux | 4.03 | 0,34 | 7.81 | 0,001 | 3.62 | 1.95-12.83 | ||
| Grégarine spp. | alimentation | 0,000001 | 11.85 | 0,11 | 21h40 | 0,000004 | 1,65 | 1.33-2.04 |
| Nyctotherus spp. | animaux | 0,020 | 49.02 | 0,29 | 8.29 | 0,004 | 0,44 | 0,25-0,77 |
| Balantidium spp. | alimentation | 0,000001 | 6.43 | 0,32 | 15.63 | 0,000072 | 3.52 | 1.69-6.57 |
| Entamoeba spp. | rotation | 0,000022 | 4,50 | 0,54 | 5,78 | 0,016 | 0,27 | 0,095-0,79 |
| alimentation | 3.58 | 0,34 | 11.03 | 0,000098 | 3.13 | 1.60-6.13 | ||
| Cestode | origine | 0,000064 | 11.66 | 1.06 | 4.71 | 0,03 | 10.07 | 1.25-81.05 |
| rotation | 8.38 | 4.46 | 4,59 | 0,035 | 2,92 | 1.08-7.92 | ||
| animaux | 2.48 | 1,50 | 6.46 | 0,011 | 18.54 | 1.95-177.14 | ||
| Pharyngodon spp. | rotation | 0,000001 | 8.24 | 0,63 | 4.25 | 0,040 | 0,27 | 0,078-0,93 |
| animaux | 11.21 | 0,73 | 14.10 | 0,00017 | 15.73 | 3.73-66.31 | ||
| Steinernema spp. | alimentation | 0,047 | 15.26 | 0,28 | 5.46 | 0,019 | 1,94 | 1.11-3.39 |
| Gordiidés | rotation | 0,000001 | 1.44 | 0,41 | 5,87 | 0,02 | 2,69 | 1.21-5.97 |
| alimentation | 4,89 | 1.03 | 18.67 | 0,000016 | 87,54 | 11.51-665.54 | ||
| Physaloptera spp. | rotation | 0,000001 | 12.28 | 0,36 | 8.62 | 0,0033 | 0,35 | 0,17-0,70 |
| animaux | 7.45 | 0,29 | 28.18 | <0,000001 | 4,75 | 2.67-8.45 | ||
| Thelastoma spp. | rotation | 0,00087 | 33.09 | 0,19 | 4.61 | 0,031 | 1.51 | 1.04- 2.21 |
| animaux | 9.44 | 0,16 | 4,89 | 0,0002 | 1.26 | 1.26-2.43 | ||
| Hammerschmidtiella diesigni | rotation | <0,000001 | 11h15 | 0,22 | 14.09 | 0,00017 | 2.32 | 1.49-3.59 |
| alimentation | 7.64 | 0,22 | 12h41 | 0,00042 | 2.18 | 1.41-3.73 | ||
| animaux | 5,82 | 0,20 | 7.47 | 0,0062 | 1,75 | 1.17-2.61 | ||
| Acanthocéphales | origine | 0,00001 | 14.23 | 0,55 | 5.11 | 0,02 | 9.11 | 1.67-73.01 |
| Acaridés | origine | 0,000001 | 5,89 | 0,20 | 13.72 | 0,00021 | 2.08 | 1.41-3.06 |
| alimentation | 7.43 | 0,20 | 11.52 | 0,00069 | 1,99 | 1.34-2.96 |
X 2 -Test du chi carré ; W — statistique de Wald ; IC à 95 % — Intervalle de confiance à 95 % ; Origine : 0 – spécimens de l’élevage venus d’Europe, 1- individus reproducteurs importés d’Asie ou d’Afrique ; Rotation : 0—individus provenant d’exploitations avec rotation animale fermée, 1—individus provenant d’exploitations avec rotation animale ouverte ; Alimentation : 0—insectes nourris avec des produits frais ou de la nourriture, 1—insectes nourris avec des déchets ; Animaux : 0—aucun contact avec des animaux, 1—contact avec des animaux. H.diesigni — Hammerschmidtiella diesigni .
Des corrélations significatives ont été observées entre la présence de Nosema spp. et Isospora spp. (V = 0,75), Gregarine spp. (Q = −0,27) Steinernema spp. (Q = 0,42) et Gordiidae spp (Q = 0,45). La présence d’ Isospora spp. était également significativement corrélé avec Gregarine spp. (Q = -0,22), cestodes (Q = 0,63), Gordiidae spp. (Q = 0,73) Thelastoma spp. (Q = 0,96). La présence de Nyctotherus spp. était corrélé avec Spiruroidea (Q = 0,55), Thelastoma spp. (Q = 0,52) et H. diesigni (Q = 0,18). Des corrélations ont été observées entre Gregarine spp. etHymenolepis diminuta (Q = 0,48), Pharyngodon spp. (Q = 0,30), Steinernema spp. (Q = 0,33), Physaloptera spp. (Q = 0,32), Spiruroidea. (Q = 0,44), Thelastoma spp. (Q = 0,51), H. diesigni (Q = 0,31) et Acanthocephala (Q = 0,44). La présence de Cryptosporidium spp. était significativement corrélé avec Balantidium spp. (Q = 0,21), Entamoeba spp. (Q = 0,33), Nyctotherus spp. (Q = −0,41), H. diesigni (Q = 0,49) et Acaridae (Q = 0,17).
Discussion
En raison de l’absence d’obligation d’enregistrement, nous ne sommes actuellement pas en mesure d’estimer le nombre exact de ces exploitations dans la zone étudiée. Le nombre d’exploitations obtenu pour l’expérimentation résulte d’un nombre minimum d’échantillons calculé à titre indicatif. Pour obtenir les résultats les plus fiables à partir d’un seul emplacement (par exemple, une ville), nous avons testé jusqu’à 3 fermes. La sélection des espèces d’insectes pour la recherche résulte de la diffusion de ces animaux auprès des éleveurs. Dans le cas où nous avons montré que les insectes provenaient du même fournisseur, nous n’avons pas poursuivi les recherches.
Les questions de l’enquête concernant les fermes d’insectes testées sont liées aux activités observées pratiquées par les éleveurs. Les éleveurs désireux d’installer ou d’agrandir leurs fermes commandent souvent des insectes dans les pays d’origine ou dans des endroits où l’importation de ces aliments est moins chère que d’Europe. À notre avis, un tel phénomène est une grande menace du fait qu’il peut y avoir un risque d’attraper des animaux de l’environnement, et donc d’introduire de nouveaux parasites, aussi bien pathogènes pour les insectes que pour l’homme et les animaux. Certains éleveurs amateurs ne s’intéressent pas à la qualité des aliments introduits dans l’élevage. Ils se nourrissent d’insectes de l’environnement (fourrage vert, arbres fruitiers sauvages) ou utilisent les restes de l’alimentation d’autres animaux. Les insectes comestibles peuvent également être en contact direct ou indirect avec les animaux. Parmi les pratiques, nous pouvons inclure la redéposition des insectes dans les fermes après que l’animal ne les a pas mangés. Ces insectes se déplaçant dans l’habitat des animaux (par exemple, les terrariums) peuvent introduire mécaniquement des agents pathogènes potentiels spécifiques aux animaux.
Au cours de la recherche dans des fermes individuelles, nous avons observé des pratiques contraires à l’éthique d’éleveurs individuels, telles que nourrir des insectes avec des excréments d’animaux provenant d’une animalerie, nourrir des insectes avec des cadavres d’animaux plus petits ou nourrir des insectes avec de la nourriture moisie et même de la viande crue. Ces pratiques réduisent considérablement la qualité du produit final et compromettent la sécurité microbiologique/parasitologique de ces aliments. Actuellement, cependant, il n’existe aucune réglementation concernant les conditions zoohygiéniques et le bien-être de ces animaux en tant qu’animaux potentiels pour l’alimentation. Bien que la recherche ait été menée dans des élevages d’insectes amateurs, la plupart ne se sont pas révélés gravement défectueux. L’élevage d’insectes comestibles effectué dans des lieux non prévus à cet effet (maisons) peut entraîner un danger supplémentaire pour l’homme. Au cours de l’étude, nous avons enregistré des cas individuels de propagation d’insectes à partir de fermes, qui ont entraîné une infestation de chambres, par exemple. par des cafards ou des grillons. Un autre exemple est la possibilité de transmission de parasites tels queCryptosporidium spp. sur l’homme par voie aérogénique, donc si les élevages ne sont pas bien protégés ou s’il y a un manque d’hygiène au contact des insectes, de telles invasions peuvent se produire.
Parasites pathogènes pour les insectes
Les échantillons de ferme analysés ont été colonisés par des formes de développement de parasites spécifiques aux insectes, notamment Nosema spp., Gregarine spp., Nyctotherus spp., Steinernema spp., Gordiidae, H. diesigni , Thelastomidae et Thelastoma spp. Ces agents pathogènes constituent la flore parasitaire la plus répandue et des infections massives peuvent compromettre la santé des insectes et réduire les bénéfices des exploitations. Selon Van der Geest et al. et Johny et al., les agents pathogènes ci-dessus ont été impliqués comme pseudo-parasites des humains et des animaux. Cependant, l’impact des parasites spécifiques aux insectes sur l’homme n’a pas encore été entièrement élucidé. Pong et al. ont avancé que Gregarine spp., un parasite spécifique des blattes, pouvait provoquer de l’asthme chez l’homme. Les résultats de l’enquête menée dans notre étude indiquent que l’élevage d’insectes peut augmenter l’exposition humaine aux agents pathogènes et allergènes.
La nosémose est une maladie causée par des parasites microsporidiens, et elle peut compromettre la santé des grillons et des criquets. Cependant, les parasites Nosema contrôlent également les populations de grillons et de criquets dans l’environnement naturel. Lange et Wysiecki ont découvert que Nosema locustae peut être transmis par des criquets sauvages jusqu’à une distance de 75 km. Ce parasite se transmet également facilement d’un insecte à l’autre, ce qui peut contribuer à la propagation des infections dans les élevages d’insectes. Johnson et Pavlikova ont rapporté une corrélation linéaire entre le nombre de Nosema spp. spores chez les criquets et une diminution de la consommation de matière sèche. Les résultats de notre étude indiquent que Nosemaspp. les infections peuvent réduire les bénéfices de l’élevage d’insectes.
Grégarine spp. sont des protistes parasites qui colonisent les voies digestives et les cavités corporelles des invertébrés. Selon Kudo, les grégarines sont des micro-organismes commensaux non pathogènes, mais des recherches récentes indiquent que ces protistes sont pathogènes pour les insectes. Ces micro-organismes utilisent les nutriments ingérés par l’hôte, compromettent la fonction immunitaire de l’hôte et endommagent les parois des cellules hôtes. Des infestations massives peuvent entraîner une occlusion intestinale chez les insectes. Lopes et Alves ont trouvé que les cafards infectés par la grégarinespp. étaient caractérisés par des abdomens gonflés, des mouvements plus lents, des corps assombris et une odeur putride indiquant une septicémie. Il a également été constaté que les grégarines compromettaient la reproduction, raccourcissaient le cycle de vie et augmentaient la mortalité chez les insectes. Une étude des libellules a révélé que Gregarine spp. peut diminuer la teneur en graisse et la force musculaire chez les insectes. Johny et al. ont démontré que le métronidazole et la griséofluvine peuvent diminuer Gregarine spp. compte chez les insectes. Les résultats présentés par Johny et al. peut être utilisé pour développer des stratégies de gestion des parasites et minimiser les effets négatifs de la grégarinespp. dans les élevages d’insectes. Lopes et Alves ont démontré que les blattes infectées par Gregarine spp. étaient plus sensibles à Metarhizium anisopliae et au triflumuron, ce qui pourrait impliquer que les insectes malades sont plus sensibles aux autres agents pathogènes. Une revue de la littérature suggère que Gregarine spp. peut affecter négativement la santé des insectes d’élevage.
Nyctotherus spp. est un parasite ou un endosymbionte qui colonise le système intestinal des insectes. Gijzen et al. ont trouvé une forte corrélation entre la taille de la population de N. ovalis et l’activité de digestion de la carboxyméthyl-cellulase et du papier filtre dans les intestins des blattes, qui était corrélée à la capacité de ces insectes à produire du méthane. Les résultats de notre étude indiquent que le cilié N. ovalis doit être considéré comme la microflore commensale du tractus gastro-intestinal de la blatte. Nyctotherus spp. étaient moins susceptibles d’être détectés chez les insectes qui avaient déjà été en contact avec des animaux. Ce qui précède pourrait impliquer que les insectes dont le tube digestif est colonisé par ces parasites sont plus facilement consommés par les animaux.Nyctotherus ovalis est rarement pathogène pour les animaux. Satbige et al. ont signalé deux tortues chez lesquelles une infection à N. ovalis a provoqué diarrhée, déshydratation et perte de poids.
Les Gordiidae, également connus sous le nom de vers de crin, sont des nématodes parasites d’une longueur pouvant atteindre 1,5 m qui colonisent les invertébrés. Lorsqu’elles sont consommées par des insectes, les larves parasites pénètrent dans la paroi intestinale et sont enveloppées par des kystes protecteurs à l’intérieur de l’intestin. Gordius spp. sont généralement spécifiques aux insectes, mais ces nématodes ont également été détectés chez l’homme et l’animal. Plusieurs cas de parasitisme et de pseudo-parasitisme par des vers gordiidés provenant de diverses localités, dont la France, l’Italie, la Bavière, la Dalmatie, l’Afrique de l’Est, l’Afrique du Sud-Est, l’Afrique de l’Ouest, le Transvaal, le Chili, les États-Unis et le Canada, ont été décrits dans la littérature. Des vers de crin ont également été identifiés dans les vomissures et les matières fécales. Cependant, aucune des invasions parasitaires décrites n’était pathogène pour l’homme. Dans la présente étude, des parasites ont été détectés chez des insectes nourris avec des déchets de cuisine ou des sources de nourriture collectées localement.
Hammerschmidtiella diesigni , Thelastoma spp. et Thelastomatidae sont des nématodes spécifiques aux invertébrés. Les nématodes colonisant le tube digestif des insectes sont généralement considérés comme des organismes commensaux. Taylor a démontré que Leidynema spp. a exercé un effet négatif sur les tissus de l’intestin postérieur chez les insectes. De même que les pathogènes identifiés dans notre étude, Leidynema spp. appartiennent à la famille des Thelastomatidae. Capinera a démontré que ces nématodes peuvent augmenter la mortalité dans les élevages de blattes. Dans notre étude, les insectes colonisés par H. diessigni et Thelastoma spp. se caractérisent par une faible teneur en tissu adipeux. McCallister ont rapporté une prévalence plus élevée de nématodes H. diesigni et T. bulhoes chez les cafards femelles et adultes, mais n’ont pas observé de variations significatives dans le nombre différentiel d’hémocytes ou la gravité spécifique de l’hémolymphe.
Steinernema spp. est un nématode entomopathogène dont la pathogénicité est liée à la présence de bactéries symbiotiques dans les intestins parasites. Ces nématodes sont utilisés en agriculture comme agents de lutte biologique contre les ravageurs des cultures, ce qui peut favoriser la propagation de l’infection à d’autres insectes. Dans notre étude, les insectes infectés par Steinernema spp. ont probablement été nourris avec des plantes contaminées par des œufs de parasites.
Parasites pathogènes pour l’homme et les animaux
Cryptosporidium spp. sont des parasites qui colonisent les voies digestives et respiratoires de plus de 280 espèces de vertébrés et d’invertébrés. Ils ont été associés à de nombreuses maladies animales impliquant une diarrhée chronique. Selon la littérature, les insectes peuvent servir de vecteurs mécaniques de ces parasites. Les mouches peuvent être des vecteurs de Cryptosporidium spp. qui transportent des oocystes dans leur tube digestif et contaminent les aliments. Les bousiers foreurs et les cafards peuvent également agir comme vecteurs mécaniques de ces parasites dans l’environnement. Cependant, la prévalence de Cryptosporidiumspp. chez les insectes comestibles n’a pas été documentée dans la littérature. Dans notre étude, Cryptosporidium spp. ont été détectés dans le tube digestif et d’autres parties du corps de toutes les espèces d’insectes évaluées. À notre avis, les insectes sont un vecteur sous-estimé de Cryptosporidium spp., et ils contribuent de manière significative à la propagation de ces parasites.
Isospora spp. sont des protozoaires cosmopolites de la sous-classe des coccidies qui provoquent une maladie intestinale connue sous le nom d’isosporose. Ces parasites constituent une menace tant pour les humains (en particulier les personnes immunodéprimées) que pour les animaux. L’hôte s’infecte en ingérant des ovocytes et l’infection se manifeste principalement par des symptômes gastro-intestinaux (diarrhée aqueuse). Selon la littérature, les blattes, les mouches domestiques et les bousiers peuvent agir comme vecteurs mécaniques d’Isospora spp.. Dans notre étude, des élevages d’insectes ont été contaminés par ce protozoaire, qui pourrait être à l’origine de coccidiose récurrente chez les insectivores. Isospora spp. ont été détectés à la surface du corps et dans le tractus intestinal des insectes. A notre avis, la présence deIsospora spp. chez les insectes comestibles résulte de mauvaises normes d’hygiène dans les élevages d’insectes.
Balantidium spp. sont des protozoaires cosmopolites de la classe Ciliata. Certaines espèces constituent la flore commensale des animaux, mais elles peuvent également provoquer une maladie connue sous le nom de balantidose. Selon la littérature, ces protozoaires sont omniprésents chez les insectes synanthropes. Chez certains insectes, Balantidium spp. est considéré comme faisant partie de la flore intestinale normale et peut participer aux processus digestifs. Les insectes peuvent être des vecteurs de Balantidium spp. pathogène pour l’homme et l’animal. Dans notre étude, des ciliés potentiellement pathogènes ont été détectés même dans des élevages d’insectes avec des habitats fermés.
Entamoeba spp. sont des amiboïdes du groupe taxonomique Amoebozoa qui sont des parasites internes ou commensaux chez l’homme et les animaux. La majorité des espèces d’Entamoeba , y compris E. coli , E. dispar et E. hartmanni , identifiées dans notre étude appartiennent à la microflore intestinale commensale non pathogène. Cependant, E. histolytica pathogène et E. invadens ont également été détectés dans l’étude présentée. Entamoeba histolytica peut provoquer la dysenterie chez l’homme et les animaux, alors que E. invadens est particulièrement dangereux pour les animaux insectivores tels que les reptiles et les amphibiens. D’autres auteurs ont démontré queE. histolytica est transmis par des insectes dans le milieu naturel.
Les cestodes colonisent les insectes en tant qu’hôtes intermédiaires. Des cysticercoïdes, le stade larvaire des ténias tels que Dipylidium caninum , Hymenolepis diminuta , H. nana , H. microstoma , H. citelli , Monobothrium ulmeri et Raillietina cesticillus , ont été identifiés chez les insectes. Les insectes ont développé des mécanismes immunitaires qui inhibent le développement de ces parasites. Les ténias peuvent induire des changements de comportement chez les insectes, tels qu’une diminution significative de l’activité et un comportement photophobe. Les changements de comportement peuvent inciter les hôtes définitifs à consommer des insectes contenant des cysticercoïdes. Notre étude a démontré que les fermes d’insectes qui sont exposées au contact avec des animaux et les fermes qui sont complétées par des insectes provenant de sources externes sont plus à risque d’infection par le ténia. Des résultats similaires ont été rapportés dans des études sur des insectes synanthropes. Dans notre étude, des cysticercoïdes et des œufs ont été détectés, ce qui suggère que les élevages peuvent être continuellement exposés à des sources d’infection. Cependant, les corrélations entre les insectes comestibles et la prévalence du taeniasis chez l’homme et l’animal n’ont jamais été étudiées en détail. Il a été démontré que la température influence de manière significative le développement des larves de ténia chez les insectes. À notre avis, le maintien d’une température plus basse dans les élevages d’insectes pourrait réduire considérablement le succès reproducteur des ténias, et les insectes comestibles pourraient être traités thermiquement avant consommation afin de minimiser le risque d’infection par le ténia. Les résultats de notre étude indiquent que les insectes comestibles jouent un rôle important dans la transmission des ténias aux oiseaux, aux animaux insectivores et aux humains.
Pharyngodon spp. sont des nématodes parasites qui colonisent les animaux exotiques dans les environnements sauvages et captifs. Ces parasites sont plus répandus chez les animaux de compagnie captifs que chez les animaux sauvages, ce qui pourrait être corrélé avec les insectes comestibles. Dans notre étude, les insectes qui avaient déjà été en contact avec des animaux étaient significativement plus souvent des vecteurs de Pharyngodon spp. nos résultats indiquent que les insectes agissent comme des vecteurs mécaniques pour la transmission des formes développementales du parasite. Le rôle des insectes comme hôtes définitifs de Pharyngodon spp. n’a pas été confirmée par la recherche. Infections humaines causées par Pharyngodonspp. avaient été notés dans le passé, mais ces nématodes ne sont plus des facteurs de risque significatifs de maladie zoonotique potentielle.
Physaloptera spp. forment des kystes dans l’hémocèle de l’hôte environ 27 jours après l’ingestion. Cawthorn et Anderson, ont démontré que les grillons et les blattes peuvent agir comme hôtes intermédiaires pour ces nématodes. Notre étude est le tout premier rapport indiquant que Physaloptera spp. peut être transmis par les vers de farine et les criquets migrateurs. Les insectes peuvent jouer le rôle de vecteurs dans la transmission de ces parasites, notamment aux mammifères insectivores. Malgré ce qui précède, les hôtes définitifs ne sont pas toujours infectés. Les blattes jouent un rôle important dans la transmission des parasites évoqués, notamment dans les jardins zoologiques. Une étude de triboliums de la farine infectés expérimentalement ( Tribolium confusum ) a démontré que les spiruridés peuvent également influencer le comportement des insectes. Les changements de comportement augmentent le risque que les insectivores sélectionnent des individus infectés.
Les spiruroides sont des nématodes parasites qui ont besoin d’hôtes intermédiaires invertébrés, tels que les bousiers ou les cafards, pour compléter leur cycle de vie. Chez les sauterelles, Spirura infundibuliformis atteint le stade infectieux en 11-12 jours à des températures ambiantes de 20-30°C. Des recherches ont démontré que ces insectes sont des réservoirs de Spiruroidea dans le milieu naturel. Ces parasites forment des kystes dans les muscles des insectes, l’hémocèle et les tubules de Malpighi. Ils colonisent principalement les animaux, mais des infections humaines ont également été signalées. Selon Haruki et al., Spiruroidea peut infecter les humains qui consomment accidentellement des hôtes intermédiaires ou boivent de l’eau contenant des larves L3 de Gongylonemaspp. (nématodes de la superfamille Spiruroidea). La prévalence de Spiruroidea chez les insectes n’a jamais été étudiée chez les insectes d’Europe centrale. Dans notre étude, ces nématodes ont été identifiés principalement dans des élevages important des insectes hors d’Europe.
Les acanthocéphales sont des endoparasites obligatoires du tube digestif chez les poissons, les oiseaux et les mammifères, et leurs larves (acanthor, acanthella, cystacanth) sont transmises par les invertébrés. La prévalence de ces parasites chez les insectes sauvages n’a jamais été étudiée. Chez les blattes, des espèces d’Acanthocephala telles que Moniliformis dubius et Macracanthorhynchus hirudinaceus pénètrent dans la paroi intestinale et atteignent l’hémocèle. La membrane externe de l’acanthor forme des protubérances ressemblant à des microvillosités qui enveloppent les larves à un stade précoce. L’influence des acanthocéphales sur la physiologie des insectes a été largement étudiée. La présence de larves de Moniliformis moniliformis dans l’hémocèle de blatte diminue la réactivité immunitaire, ce qui, à notre avis, peut contribuer à des infections secondaires. Les vers à tête épineuse influencent la concentration de phénoloxydase, une enzyme responsable de la synthèse de mélanine au site de la blessure et autour des agents pathogènes dans l’hémolymphe . Il n’y a pas d’études publiées décrivant l’impact des acanthocéphales sur le comportement des insectes. Une étude sur les crustacés a démontré que les formes de développement de ces parasites augmentaient significativement les niveaux de glycogène et diminuaient la teneur en lipides chez les femelles. Les vers à tête épineuse compromettent également le succès reproducteur des crustacés. Des recherches supplémentaires sur les arthropodes sont nécessaires pour déterminer la sécurité des insectes en tant que sources d’alimentation humaine et animale. Des acanthocéphales ont été détectés chez des reptiles insectivores, ce qui pourrait indiquer que les insectes peuvent agir comme vecteurs de transmission de formes développementales parasites.
Les Pentastomida sont des arthropodes endoparasites qui colonisent les voies respiratoires et les cavités corporelles des reptiles sauvages et captifs. La pentastomose est considérée comme une maladie zoonotique, en particulier dans les pays en développement. La présence d’acariens, qui ressemblent à des nymphes pentastomides lors d’observations microscopiques, doit être exclue lors du diagnostic de pentastomose dans les élevages d’insectes. Le rôle des insectes hôtes intermédiaires/vecteurs des nymphes pentastomides n’a pas encore été entièrement élucidé. Cependant, Winch et Riley ont découvert que les insectes, y compris les fourmis, sont capables de transmettre les vers de la langue et que les cafards sont réfractaires à l’infection par Raillietiella gigliolii . Esslinger, et Bosch, ont démontré que Raillietiella spp. compter sur les insectes comme hôtes intermédiaires. Notre étude a confirmé la possibilité ci-dessus, mais nous n’avons pas été en mesure d’identifier les facteurs qui font des insectes sélectionnés les hôtes intermédiaires préférés. Le choix de l’hôte intermédiaire est probablement déterminé par l’espèce de parasite. Nous n’avons pas été en mesure d’identifier les nymphes pentastomides au niveau de l’espèce en raison de l’absence de données morphométriques détaillées. Nos résultats et les découvertes d’autres auteurs suggèrent que les insectes pourraient être des vecteurs importants pour la transmission des pentastomides aux reptiles et aux amphibiens.
Prévalence
La prévalence des infections parasitaires chez les insectes a été étudiée principalement dans le milieu naturel. Thyssen et al. ont constaté que 58,3 % des blattes germaniques étaient porteuses de nématodes, dont des œufs d’Oxyuridae (36,4 %), des œufs d’Ascaridae (28,04 %), des larves de nématodes (4,8 %), d’autres nématodes (0,08 %) et des œufs de Toxocaridae (0,08 %) . Des œufs de cestodes (3,5 %) ont également été détectés dans l’étude ci-dessus. Chamavit et al. rapportent la présence de parasites chez 54,1 % des blattes, dont Strongyloides stercoralis (0,8 %), Ascaris lumbricoides (0,3 %), Trichuris trichuria (0,3 %), Taenia spp. (0,1 %), Cyclospora spp. (1.3%), Endolimax nana(1,3 %), B. hominis (1,2 %), Isospora belli (9,6 %), Entamoeba histolytica / E. dispar (4,6 %), Cryptosporidium spp. (28,1 %), Chilomastix mesnilli (0,3 %), Entamoeba coli (4,0 %), Balantidium coli (5,8 %) et Iodamoeba butschlii (0,1 %). Les parasites spécifiques à l’homme tels que Oxyuridae, Ascaridae, Trichuris spp. et Taeniaspp. n’ont pas été détectés dans notre étude, ce qui suggère que les insectes analysés n’ont pas eu accès aux excréments d’humains infectés. Dans une étude sur les blattes sauvages en Irak, la prévalence des formes développementales parasitaires était près de deux fois plus élevée (83,33 %) que dans notre étude. Les blattes irakiennes portaient E. blatti (33%), N. ovalis (65,3%), H. diesingi (83,3%), Thelastoma bulhoe (15,4%), Gordius robustus (1,3%), Enterobius vermicularis , (2%) et Ascaris lumbricoides (1,3 %). Contrairement à notre expérience, H. diesgniétait l’espèce de nématode prédominante chez les blattes irakiennes. Les auteurs cités n’ont identifié aucune forme développementale de ténias. Tsai et Cahill ont analysé les blattes de New York et identifié Nyctotherus spp. dans 22,85% des cas, Blatticola blattae dans 96,19% des cas, et Hammerschmidtiella diesingi dans 1,9% des cas. Les résultats de notre étude suggèrent que les insectes comestibles d’élevage sont moins exposés à certains parasites (Ascaridae, Enterobius spp.) pathogènes pour l’homme et l’animal. L’absence de nématodes et de vers ronds spécifiques à l’homme pourrait être attribuée au fait que les fermes analysées étaient des habitats fermés sans accès à des sources infectieuses. Dans les travaux de Fotedar et al., la prévalence des parasites a été déterminée à 99,4 % chez les blattes hospitalières et à 94,2 % chez les blattes domestiques. Le pourcentage de blattes infectées était beaucoup plus élevé que dans notre étude, ce qui pourrait indiquer que les facteurs environnementaux influencent de manière significative la prévalence des espèces de parasites sélectionnés. Nos observations confirment que le risque d’infections parasitaires peut être considérablement minimisé lorsque les insectes sont élevés en milieu clos. La forte prévalence de certaines formes de développement de parasites dans les élevages d’insectes évalués pourrait être attribuée aux faibles normes d’hygiène et à l’absence de traitements préventifs. La faune parasitaire des élevages d’insectes n’a jamais été décrite dans la littérature à une telle échelle. Ces résultats pourraient être attribués au fait que tous les insectes examinés provenaient d’un seul stock, ce qui a contribué à la réémergence d’infections parasitaires. Des observations similaires ont été faites dans plusieurs fermes d’insectes dans la présente étude.
La transformation des insectes comestibles comme la cuisson ou la congélation peut inactiver les formes de développement parasites. Tanowitz et al. ont rapporté que Teania solium est tué en faisant cuire le porc à une température interne de 65°C ou en le congelant à 20°C pendant au moins 12 heures. Fumer, sécher ou congeler de la viande peut également inactiver des protozoaires comme Toxoplasma gondii. L’utilisation de micro-ondes peut être inefficace. Sur l’exemple d’ Anisakis simplex , il a été prouvé que la cuisson et la congélation peuvent améliorer significativement la sécurité alimentaire vis-à-vis de ce nématode. Faire bouillir l’insecte pendant 5 minutes est également un processus efficace pour éliminer les entérobactéries. Des méthodes de conservation simples telles que le séchage/acidification sans utiliser de réfrigérateur ont été testées et considérées comme prometteuses. Cependant, il est nécessaire d’évaluer en profondeur les méthodes de traitement des insectes, y compris les températures et le temps de cuisson/congélation pour prévenir d’éventuelles infections parasitaires. Malgré les processus de préparation des aliments, des allergènes parasites peuvent encore être détectés.
Les insectes peuvent également être un vecteur/réservoir bactérien, mais il n’existe actuellement aucune donnée disponible pour les tests bactériologiques chez les insectes reproducteurs. Il a été prouvé que les insectes peuvent être un facteur épidémiologique important dans la transmission des maladies bactériennes. L’une des bactéries les plus importantes transmises par les insectes comprend Campylobacter spp. et Salmonella spp.. Kobayashi et al. ont montré que l’insecte pouvait aussi être un vecteur d’ Escherichia coli 0157:H7. Les blattes libres abritaient des organismes pathogènes comme Escherichia coli , Streptococcus Group D, Bacillus spp.,Klebsiella pneumoniae et Proteus vulgaris. Des études in vitro ont montré que certaines espèces d’insectes peuvent également être le réservoir de Listeria monocytogenes. À notre avis, des recherches supplémentaires devraient également se concentrer sur la sécurité microbiologique de l’élevage d’insectes comestibles.
Étant donné que l’identification des parasites était basée sur des méthodes morphologiques et morphométriques, les recherches moléculaires ultérieures devraient se concentrer sur la détermination précise des espèces individuelles de parasites identifiés afin de déterminer la menace réelle pour la santé publique. Les résultats de cette étude indiquent que les insectes comestibles jouent un rôle important dans l’épidémiologie des maladies parasitaires chez les vertébrés. Les insectes comestibles agissent comme des vecteurs importants pour la transmission de parasites aux animaux de compagnie insectivores. Les élevages d’insectes qui ne respectent pas les normes d’hygiène ou sont établis dans des endroits inappropriés (par exemple, des maisons) peuvent présenter des risques directs et indirects pour les humains et les animaux. Par conséquent, les fermes fournissant des insectes comestibles doivent être régulièrement contrôlées pour les parasites afin de garantir la sécurité des sources d’alimentation humaine et animale. La quantité de parasites est liée à la cause des maladies humaines et animales. Par conséquent, à l’avenir, des études quantitatives de l’intensité des parasites dans les élevages d’insectes devraient être réalisées. À notre avis, la méthode de recherche quantitative la plus fiable serait la méthode PCR en temps réel. Des normes de bien-être des insectes et des méthodes d’analyse devraient également être élaborées pour minimiser les pertes de production et éliminer efficacement les agents pathogènes des élevages.



 Les insectes dans les cantines scolaires Transmission de maladie parasitaire: Modèle d’email à adapter
Les insectes dans les cantines scolaires Transmission de maladie parasitaire: Modèle d’email à adapter
 La Commission européenne autorise que des grillons soient mélangés à vos aliments sans vous en avertir correctement
La Commission européenne autorise que des grillons soient mélangés à vos aliments sans vous en avertir correctement



C le g.no.ci.de le plus important depuis la naissance de l’humanité. Nous sommes gouvernés par des psychopathes richissimes qui détiennent le monde, qui ont choisis de nous ex.ter.mi.ner en grande majorité. Car, nous avons justement, les moyens technologiques pour être remplacés par des robots d’apparence Humaine, pour effectuer les tâches, et pour servir ces monstres au pouvoir. De plus, ils désirent formater nos propres enfants pour l’homosexualite, afin de légaliser les futures naissances en couveuses artificielles, où nous pourrions choisir nos futurs enfants tout comme un objet, avec choix des couleurs des yeux, sexe, etc… sans plus jamais aucune union de couples, mais, seulement en couveuses artificielles pour leurs Grand Reseat tellement calculé, depuis des décennies déjà par nos propres élites machiavéliques.
J’espère que l’humanité se réveillera, avant que ces psychopathes au pouvoir nous auront exterminés. Que tous comprennent qu’il faut impérativement cesser d’obéir aux ordres, pour contrecarrer leurs plans machiavéliques.
Jamais je n’aurais Imaginé qu’il existe autant de personnes consentantes sans se poser les bonnes questions, et laisser nos toubibs et infirmiers intègres, abandonnés comme des malpropres, sans lever le petit doigt. Jamais n’aurais pu imaginer que c’est la grande majorité qui accepte tout, sans aucune condition, qui nous mènent droit vers une dictature, après un g.no.ci.de pareil !!!!. Peu sont éveillés, et peu comprennent les manipulations de nos élites pour nous éradiquer en grande majorité, et asservir totalement les survivants par un contrôle absolu.
Notre société actuelle est programmée pour créer une population pédo- sa.ta.ni.que… et pédophile, où nos enfants sont les premières victimes, pour les formater à une normalité dés leurs plus jeunes âges, pour leurs faire croire que tout est normal. Qu’ils doivent tout accepter. Que c’est La nouvelle Norme… Bien que tout soit particulièrement bien orchestré pour nous imposer l’Ordre Mondial, où nous n’aurions seulement que des enfants nés sans humain, mais en couveuses artificielles dénués d’âmes, et d’amour. L’amour devrait être banni de ce monde, pour imposer leurs Great Reseat.