Il est temps que la peur change de camp. La rhétorique du « danger complotiste » qui menacerait un prétendu « consensus scientifique » est un bobard propagé par des organisations et des personnes n’ayant aucun respect pour la science et la recherche désintéressée de la vérité. En novembre 2021, la société Facebook, qui sous-traite sa prétendue « vérification de faits » à une autre entreprise commerciale, s’est crue autorisée à censurer la page du British Medical Journal, une des plus anciennes et des plus prestigieuses revues de sciences médicales, pour la simple raison que celle-ci publiait un article mettant en cause l’intégrité des données contenues dans les essais cliniques de Pfizer. De telles pratiques, qui concernent tout autant les autres géants du numérique, de Google, à YouTube, Twitter ou Instagram, devraient ouvrir les yeux sur l’incroyable prise de contrôle du débat public par la propagande industrielle à laquelle nous assistons depuis trois ans, avec la complicité de nombreux gouvernements et de la plupart des journalistes occidentaux. Lorsqu’une telle censure est organisée, la science est muselée et la démocratie vacille
Je publie ici la traduction en français (merci à Guillaume Girard) de deux articles parus dans le British Medical Journal les 2 novembre 2021 et 19 janvier 2022. Le premier (consultable ici) est signé par Paul Thacker, journaliste d’investigation travaillant régulièrement avec la revue. Le second (consultable ici) est signé par Rebecca Coombes et Madlen Davies qui dirige la rubrique d’enquête de la revue. Ces articles courts et purement factuels se lisent aisément et ne nécessitent pas davantage d’explications.
* * * * *
Covid-19 : une chercheuse lance l’alerte sur
l’intégrité des données dans l’essai des vaccins Pfizer
Par Paul D. Thacker, journaliste d’investigation
À l’automne 2020, le président-directeur général de Pfizer, Albert Bourla, a publié une lettre ouverte aux milliards de personnes dans le monde qui attendaient un vaccin sûr et efficace contre la COVID-19 pour mettre fin à la pandémie. « Comme je l’ai déjà dit, nous travaillons à la vitesse de la science », écrivait Bourla, expliquant au public quand il pouvait s’attendre à ce qu’un vaccin Pfizer soit autorisé aux États-Unis.
Mais, pour les chercheurs qui testaient le vaccin de Pfizer dans plusieurs sites au Texas cet automne-là, la vitesse est peut-être advenue au détriment de l’intégrité des données et de la sécurité des patients. Un directeur régional, employé dans l’organisme de recherche Ventavia Research Group, a déclaré au BMJ que la société a falsifié des données, dévoilé les catégories des injections des patients, employé des vaccinateurs mal formés, et tardé à rapporter le suivi des événements indésirables signalés dans l’essai de phase III de Pfizer. L’équipe qui effectuait les contrôles de qualité a été débordée par le volume des problèmes qu’ils découvraient. Après avoir notifié à plusieurs reprises ces problèmes à Ventavia, la directrice régionale, Brook Jackson (voir la vidéo n°1), a envoyé une plainte par courriel à la FDA (Food and Drug Administration). Ventavia l’a licenciée un peu plus tard le même jour. Madame Jackson a fourni au BMJ des douzaines de documents internes de l’entreprise, des photos, des enregistrements audios et des courriels.
Mauvaise gestion des laboratoires
Sur son site internet, Ventavia se revendique la plus grande entreprise privée de recherche clinique au Texas et énumère les nombreux prix remportés pour son travail contractuel. Mais Madame Jackson a déclaré au BMJ que, pendant les deux semaines où elle a travaillé chez Ventavia en septembre 2020, elle a informé à plusieurs reprises ses supérieurs de la mauvaise gestion des laboratoires, de préoccupations relatives à la sécurité des patients et des problèmes d’intégrité des données. Madame Jackson était une vérificatrice d’essais cliniques chevronnée qui occupait auparavant un poste de directrice des opérations et qui est arrivée à Ventavia avec plus de 15 ans d’expérience en coordination et en gestion de la recherche clinique. Exaspérée que Ventavia ne s’occupe pas de ces problèmes, Jackson a documenté plusieurs affaires tard dans la nuit, prenant des photos sur son téléphone portable. Une photo, fournie au BMJ, présente des aiguilles jetées dans un sac en plastique et non dans une boîte réservée aux objets tranchants. Une autre présente des emballages de vaccin avec les numéros de code des participants à l’essai écrits dessus et laissés en évidence, permettant éventuellement d’identifier les participants. Les cadres de Ventavia ont ultérieurement interpellé Madame Jackson pour avoir pris ces photos.
Il se peut que le dévoilement [des participants/des lots] ait eu lieu à une échelle beaucoup plus grande, tôt et par inadvertance. D’après la présentation du plan d’expérience, une équipe informée des codages était responsable de la préparation et de l’administration du produit étudié (vaccin de Pfizer vs placebo). Ceci pour préserver l’aveuglement des participants à l’essai et de tout le personnel du site, y compris le chercheur principal. Toutefois, Madame Jackson a dit au BMJ que, chez Ventavia, des copies imprimées de l’affectation des produits étaient laissées dans les dossiers des participants, accessibles au personnel n’en ayant pas connaissance. Comme mesure corrective prise en septembre, deux mois après le début du recrutement pour l’essai et avec environ 1000 participants déjà inscrits, les instructions de contrôle de la qualité ont été mises à jour afin de supprimer des dossiers l’identification des produits administrés.
Dans un enregistrement d’une réunion de fin septembre 2020 entre Jackson et deux directeurs, un cadre de Ventavia peut être entendu exposer que l’entreprise n’a pas été en mesure de quantifier les types et le nombre d’erreurs qu’elle a commises lors de l’examen des documents de contrôle de la qualité de l’essai. « Dans mon esprit, c’est quelque chose de nouveau chaque jour », dit un cadre de Ventavia. « Nous savons que c’est important. »
Ventavia ne tenait pas à jour les requêtes de saisie de données, montre un e-mail envoyé par ICON, l’organisation de recherche de contrat avec laquelle Pfizer a collaboré sur l’essai. ICON a fait un rappel à Ventavia dans un courriel de septembre 2020 : « L’objectif prévu est que toutes les demandes de renseignements soient traitées dans les 24 heures. » ICON a ensuite mis en surbrillance en jaune plus de 100 requêtes en suspens datant de plus de trois jours. Ces exemples incluaient deux cas indiquant que « le sujet a présenté des symptômes ou des réactions graves… Selon le protocole, les sujets qui présentent des réactions de niveau 3 doivent être contactées. Veuillez confirmer qu’un CONTACT NON PROGRAMMÉ a été établi et mettre à jour le formulaire correspondant, au besoin. » Le protocole de l’essai prévoit qu’un contact téléphonique aurait dû avoir lieu « pour s’assurer de plus de précisions et déterminer si une visite sur place est cliniquement indiquée ».
Inquiétudes au sujet de l’inspection par la FDA
Des documents démontrent que des problèmes existaient depuis des semaines. Dans une liste de « mesures de suivi » distribuée aux dirigeants de Ventavia au début d’août 2020, peu après le début de l’essai et avant l’embauche de Jackson, un membre de la direction de Ventavia a identifié trois membres du personnel du site avec qui il fallait « passer en revue la gestion du journal électronique ou falsifier les données, etc. » L’un d’eux a été « intimé oralement de changer les données et de ne pas noter les entrées tardives », indique une note.
À plusieurs reprises au cours de la réunion de fin septembre, Jackson et les dirigeants de Ventavia ont discuté de la possibilité que la FDA se présente pour une inspection (cf. encadré). « Nous allons recevoir au moins un genre de lettre d’information lorsque la FDA arrivera ici […] sachez-le », a déclaré un cadre.
Encadré – Un historique de surveillance laxiste
En ce qui concerne la FDA et les essais cliniques, Elizabeth Woeckner, présidente de Citizens for Responsible Care and Research Incorporated (CIRCARE), affirme que la capacité de surveillance de l’organisme est gravement sous-dotée. Si la FDA reçoit une plainte au sujet d’un essai clinique, elle dit que l’agence a rarement le personnel disponible pour se présenter et inspecter. Et parfois la surveillance intervient trop tard. Dans un exemple, CIRCARE et l’organisation américaine de défense des consommateurs Public Citizen, accompagnés de douzaines d’experts en santé publique, ont déposé une plainte détaillée en juillet 2018 auprès de la FDA au sujet d’un essai clinique qui ne respectait pas la réglementation sur la protection des participants humains. Neuf mois plus tard, en avril 2019, un enquêteur de la FDA a inspecté le site clinique. En mai de cette année, la FDA a envoyé au prestataire d’essai une lettre d’avertissement qui corroborait bon nombre des allégations contenues dans les plaintes. Qui précisait : « Il semble que vous n’ayez pas respecté les exigences légales applicables et les règlements de la FDA régissant la conduite des enquêtes cliniques et la protection des sujets humains ». « Il y a tout bonnement une absence totale de surveillance des organismes de recherche sous contrats et des structures de recherche clinique indépendante », déclare Jill Fisher, professeure de médecine sociale à l’École de médecine de l’Université de Caroline du Nord et auteure de « Recherche médicale à louer : l’économie politique des essais cliniques pharmaceutiques ».
Ventavia et la FDA
Un ancien employé de Ventavia a déclaré au BMJ que l’entreprise était nerveuse et s’attendait à un audit fédéral de son essai du vaccin Pfizer.
Jill Fisher [NdT : Professeur de médecine sociale] a déclaré au BMJ : « Les gens qui travaillent dans la recherche clinique sont terrifiés par les vérifications de la FDA », mais elle a ajouté que l’agence fait rarement autre chose que d’inspecter les documents, habituellement des mois après la fin d’un essai. « Je ne sais pas pourquoi ils ont si peur d’eux ». Mais elle a ajouté qu’elle était surprise que l’agence n’ait pas inspecté Ventavia après un dépôt de plainte par un employé. « On pourrait penser que, s’il y a une plainte précise et crédible, ils devraient ouvrir une enquête », a dit Fisher.
En 2007, le Bureau de l’inspecteur général du ministère de la Santé et des Services sociaux a publié un rapport sur la surveillance par la FDA des essais cliniques menés entre 2000 et 2005. Le rapport indique que la FDA n’a inspecté que 1% des sites d’essais cliniques. Les inspections effectuées par la direction des vaccins et des produits biologiques de la FDA ont diminué au cours des dernières années, avec seulement 50 inspections réalisées au cours de l’année 2020 (voir ici).
Le matin suivant, du 25 septembre 2020, Jackson a appelé la FDA pour alerter au sujet des pratiques douteuses dans l’essai clinique de Pfizer chez Ventavia. Elle a ensuite fait part de ses préoccupations dans un courriel à l’agence. Dans l’après-midi, Ventavia licenciait Jackson — jugée « pas une bonne recrue », selon son courrier de licenciement. Jackson a dit au BMJ que c’était la première fois qu’elle avait été licenciée dans sa carrière de 20 ans dans la recherche.
Des préoccupations soulevées
Dans son courriel du 25 septembre à la FDA Jackson a écrit que Ventavia avait inscrit plus de 1000 participants pour trois sites. L’essai complet (enregistré sous le numéro NCT04368728) comportait environ 44 000 participants répartis sur 153 sites qui comprenaient de nombreuses entreprises et centres universitaires. Elle a ensuite énuméré une douzaine de préoccupations dont elle avait été témoin, notamment :
• Participants placés dans un couloir après l’injection et non surveillés par le personnel clinique ;
• Défaut de suivi en temps opportun des patients sujets à des effets indésirables ;
• Dérogations au protocole non signalées ;
• Vaccins stockés à des températures inappropriées ;
• Échantillons de laboratoire mal étiquetés ;
• Critique du personnel de Ventavia signalant des problèmes de ces types.
En quelques heures, Jackson a reçu un courriel de la FDA la remerciant de ses préoccupations et l’avisant que la FDA ne pouvait pas commenter toute enquête qui pourrait en résulter. Quelques jours plus tard, Jackson a reçu un appel d’un inspecteur de la FDA pour discuter de son rapport, mais on lui a dit qu’aucun autre renseignement ne pouvait être communiqué. Elle n’a ensuite plus entendu parler de son rapport.
Dans le document de Pfizer, présenté lors de la réunion du 10 décembre 2020 du comité consultatif de la FDA, support de la demande de Pfizer d’autorisation d’utilisation d’urgence de son vaccin contre la COVID-19, l’entreprise n’a fait aucune mention des difficultés rencontrées sur le site de Ventavia. Le lendemain, la FDA a délivré l’autorisation du vaccin.
En août de cette année, après l’approbation complète du vaccin de Pfizer, la FDA a publié un résumé de ses inspections de l’essai central de l’entreprise. Neuf des 153 sites d’essai ont été inspectés. Les sites de Ventavia n’étaient pas répertoriés parmi les neuf, et aucune inspection des sites où des adultes ont été recrutés n’a eu lieu dans les huit mois suivant l’autorisation d’urgence de décembre 2020. Le responsable de l’inspection de la FDA a précisé que « l’intégrité des données et la vérification du dispositif de surveillance de recherche biologique ont été limitées car l’étude était encore en cours et les données requises pour la vérification et la comparaison n’étaient pas encore disponibles pour cette nouvelle substance expérimentale ».
Témoignages d’autres employés
Au cours des derniers mois, Jackson a renoué avec plusieurs anciens employés de Ventavia qui ont tous quitté l’entreprise ou ont été licenciés. L’un d’eux était un des fonctionnaires qui avait participé à la réunion de fin septembre. Dans un message texte envoyé en juin, l’ancien fonctionnaire s’est excusé en disant que « tout ce dont vous vous plaigniez était avéré ».
Deux anciens employés de Ventavia ont parlé au BMJ de façon anonyme par crainte de représailles et de perte de perspectives d’emploi dans la communauté de recherche très resserrée. Les deux ont confirmé les aspects généraux de la plainte de Jackson. L’une d’elles a dit qu’elle avait travaillé à plus de quatre douzaines d’essais cliniques au cours de sa carrière, y compris de nombreux essais de grande envergure, mais qu’elle n’avait jamais connu un environnement de travail aussi « embrouillé » que celui de Ventavia pour l’essai de Pfizer. « Je n’ai jamais eu à faire ce qu’on me demandait de faire », a-t-elle dit au BMJ. « Cela semblait un peu différent de la normale – les choses qui étaient permises et attendues ». Elle a ajouté que pendant son séjour à Ventavia, la société s’attendait à une vérification fédérale, mais que cela n’est jamais arrivé.
Après le départ de Jackson, les problèmes ont persisté chez Ventavia, a déclaré cette employée. Dans plusieurs cas, Ventavia n’avait pas suffisamment d’employés pour prélever les échantillons de tous les participants à l’essai qui avaient signalé des symptômes de la Covid-19, aux fins de tests d’infection. Selon l’employée, la Covid-19 symptomatique confirmée en laboratoire était le principal paramètre de l’essai. Une note d’examen de la FDA publiée en août de cette année indique que dans l’ensemble de l’essai, 477 personnes potentiellement cas de Covid-19 symptomatique n’ont pourtant pas été testées. « Je ne pense pas qu’il s’agissait de bonnes données propres », a déclaré l’employée au sujet des données générées par Ventavia pour l’essai Pfizer. « C’est un désastre invraisemblable. »
Une deuxième employée a également décrit un environnement chez Ventavia différent de tous ceux qu’elle avait connus en 20 ans de recherche. Elle a dit au BMJ que, peu après que Ventavia ait licencié Jackson, Pfizer a été informé des problèmes chez Ventavia à propos de l’essai du vaccin et un audit a eu lieu.
Depuis que Jackson a signalé des problèmes avec Ventavia à la FDA en septembre 2020, Pfizer a missionné Ventavia comme sous-traitant de recherche pour quatre autres essais cliniques de vaccins (vaccin contre la Covid-19 chez les enfants et les jeunes adultes, les femmes enceintes et pour une dose de rappel, ainsi qu’un essai de vaccin contre le VRS ; NCT04816643, NCT04754594, NCT04955626, NCT05035212). Le comité consultatif des centres de prévention et de contrôle des maladies (CDC) doit discuter de l’essai d’un vaccin pédiatrique contre la Covid-19 le 2 novembre.
* * * * *
Facebook face au BMJ : quand la vérification des faits tourne mal
Par Rebecca Coombes, responsable du journalisme,
& Madlen Davies, rédactrice en chef des enquêtes
Le 3 novembre, Howard Kaplan, un dentiste à la retraite d’Israël, a publié un lien vers un article d’enquête du BMJ dans un groupe Facebook privé. L’enquête a révélé de mauvaises pratiques d’essais de recherche clinique chez Ventavia, une société de recherche sous contrat concourant à mener l’essai principal du vaccin Pfizer contre la covid-19.
L’article généra un trafic record sur bmj.com et a été largement partagé sur Twitter, lui permettant d’atteindre le second score « Altmetric » le plus élevé de tous les temps de toutes les publications biomédicales (voir ici). Mais une semaine après sa publication, Kaplan s’est réveillé avec un message de Facebook. (Fig. 1).
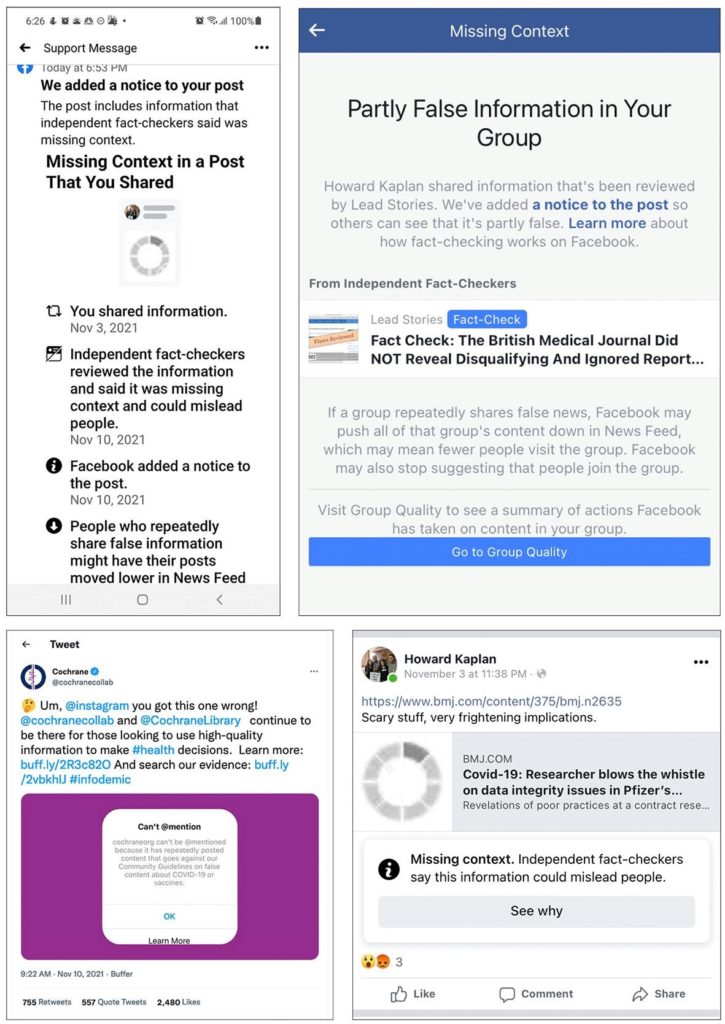
« La police de la pensée de Facebook m’a lancé un terrible avertissement », a-t-il écrit dans un nouveau message. « Le « vérificateur de faits indépendant » de Facebook n’aime pas le libellé de l’article du BMJ. Et si je ne supprime pas mon message, ils menacent de rendre mes messages moins visibles. Évidemment, je ne supprimerai pas mon post. . . S’il semble que j’ai disparu pendant un certain temps, vous saurez pourquoi ».
Kaplan n’était pas le seul utilisateur de Facebook à avoir des problèmes. Bientôt, plusieurs lecteurs du BMJ alertaient le journal sur la censure de Facebook. Au cours des deux derniers mois, l’équipe de rédaction du journal a navigué sans succès dans un processus d’appel opaque, et encore aujourd’hui, son enquête reste masquée sur Facebook.
Cette expérience a soulevé de sérieuses inquiétudes concernant la « vérification des faits » entreprise par des fournisseurs tiers au nom de Facebook, en particulier le manque de responsabilité et de surveillance de leurs actions, et la censure d’informations qui en résulte.
« Contexte manquant »
À partir du 10 novembre, les lecteurs du BMJ ont commencé à signaler divers problèmes lorsqu’ils tentaient de partager son enquête sur Facebook. Certains ont déclaré ne pas pouvoir la partager. Beaucoup d’autres ont rapporté que leur publication était signalée d’un avertissement de « contexte manquant ». Des vérificateurs de faits indépendants disent que ces informations pourraient induire les gens en erreur. » Facebook a déclaré aux rédacteurs que les personnes qui partageaient à plusieurs reprises de « fausses informations » pourraient voir leurs messages déplacés plus bas dans son fil d’actualité. Dans un groupe Facebook privé, composé de personnes ayant eu des effets indésirables neurologiques à long terme après la vaccination, les administrateurs du groupe ont reçu un message de Facebook les informant qu’un message lié à l’enquête du BMJ était « partiellement faux » (cf. fig. 1).
Les lecteurs ont été dirigés vers une « vérification des faits » effectuée par Lead Stories, l’une des 10 entreprises sous contrat avec Facebook aux États-Unis, dont le slogan est « démystifier les fausses nouvelles dès qu’elles apparaissent ». Une analyse de l’année dernière a montré que Lead Stories était responsable de la moitié de toutes les vérifications des faits de Facebook.
L’article de Lead Stories a déclaré qu’aucune des failles identifiées par la lanceuse d’alerte du BMJ, Brook Jackson, ne pouvait « disqualifier » les données recueillies lors de l’essai principal du vaccin Pfizer. Citant un porte-parole de Pfizer, cet article précisait que la société pharmaceutique avait examiné les préoccupations de Jackson et pris « des mesures pour corriger et y remédier » quand c’était nécessaire. Un porte-parole de Pfizer a déclaré que l’enquête de la société « n’a identifié aucun problème ou préoccupation susceptible d’invalider les données ou de compromettre l’intégrité de l’étude ». Lead Stories a également déclaré que Jackson n’avait pas « exprimé un soutien sans réserve pour les vaccins covid » et n’avait travaillé sur le site d’essai que pendant deux semaines.
Aucune erreur trouvée
L’article de Lead Stories, bien qu’il n’ait identifié aucune erreur dans l’enquête du BMJ, portait néanmoins pour titre « Fact Check : Le British Medical Journal N’A PAS révélé de rapports disqualifiant et ignorés à propos de failles dans les essais de vaccins Covid-19 de Pfizer ».
Le premier paragraphe décrivait à tort le BMJ comme un « blog d’actualités » et était accompagné d’une capture d’écran de l’article d’enquête avec un cachet indiquant dessus « examen des défauts », bien que l’article de Lead Stories n’identifie quoi que ce soit de faux ou d’inapproprié. Lead Stories n’a pas mentionné que l’enquête avait fait l’objet d’un examen externe par des pairs, bien que cela soit indiqué dans l’article, et a publié son article sous une URL usant de l’expression « hoax-alert ».
Le BMJ a contacté Lead Stories, lui demandant de retirer son article. Ce qui fut refusé. L’auteur de l’article, Dean Miller, a répondu que Lead Stories n’était pas responsable des actions de Facebook. « Dans le système Facebook, nous avons signalé l’article sous « contexte manquant », la catégorie de signalement la plus basse possible » explique Miller. « D’après ce que j’ai compris, la mise en évidence par Facebook ne ralentit pas la distribution ou le trafic en fonction d’une note de « contexte manquant ». Je me trompe peut-être, mais je crois que le résultat n’est qu’un indicateur du contenu ». Miller a défendu son article en notant : « Nous n’avons pas remis en question l’intégrité du reportage du BMJ, seulement son intelligibilité. C’est l’objet d’une mention de « contexte manquant » ». « Nous ne pourrions être davantage d’accord avec vous, le public devrait être préoccupé, à condition qu’il dispose de tout le contexte, ce que nous avons tenté de souligner et ce qui, en quelque sorte, a fourni un complément au rapport du BMJ ».
Le BMJ a basé son reportage sur des dizaines de documents originaux fournis par Jackson l’auditrice expérimentée d’essais cliniques devenu lanceuse d’alertes, et était confiant dans l’authenticité de sa démonstration. Après la publication, et comme indiqué dans une réponse rapide sur bmj.com, le BMJ a contacté Ventavia, Pfizer et la Food and Drug Administration (FDA) des États-Unis pour bien clarifier la portée et les implications des problèmes identifiés chez Ventavia et quelles mesures correctives avaient été prises. Au moment de mettre sous presse, Ventavia n’avait pas répondu aux demandes d’informations répétées du BMJ.
Pfizer a déclaré au BMJ qu’il avait enquêté sur une plainte anonyme concernant Ventavia en septembre 2020 et que « des mesures ont été prises pour corriger et remédier lorsque nécessaire ». La FDA a déclaré qu’elle n’était pas en mesure de répondre aux questions du BMJ, « s’agissant d’une affaire en cours ».
Dans un e-mail ultérieur, Alan Duke, rédacteur en chef de Lead Stories, a déclaré au BMJ que la mention « contexte manquant » avait été créée par Facebook spécifiquement « pour traiter le contenu qui pourrait induire en erreur sans ajout de contexte mais qui était par ailleurs vrai ou réel ». Il a ajouté que l’article était largement partagé et commenté par les militants anti-vaccins sur Facebook. « Nous convenons que parfois les messages de Facebook sur les étiquettes de vérification des faits peuvent sembler trop agressifs et effrayants. Si vous avez un problème avec leur messagerie, vous devriez en effet en parler avec eux car nous ne pouvons rien y changer. »
Le BMJ a également contacté l’International Fact-Checking Network (IFCN), géré par le Poynter Institute for Media Studies, une école de journalisme à but non lucratif à Saint-Petersburg, en Floride, dont les mécènes comprennent Facebook et Google. L’IFCN établit des normes de qualité pour les organisations de vérification des faits et crée une liste vérifiée des entreprises qui répondent à ces normes, y compris Lead Stories, a déclaré l’institut Poynter qui a renvoyé le BMJ vers Facebook.
Gary Schwitzer, professeur agrégé associé à l’école de santé publique de l’Université du Minnesota et éditeur de Health News Review, qui évalue les reportages sur la santé des agences de presse américaines, a déclaré qu’il y avait un « conflit d’intérêts inhérent » dans l’utilisation par Facebook d’organisations tierces pour vérifier le contenu. « Ainsi, une entreprise confrontée à une crise de crédibilité vous engage pour l’aider », a-t-il déclaré au BMJ. « Il y a de la sorte une pression inhérente sur le prestataire, s’il veut être payé, à soulever des problèmes et sembler aider à les résoudre. »
Il a déclaré que les processus au moyen desquels Facebook décidait quel contenu envoyer pour vérification des faits, et les systèmes des prestataires pour décider quels éléments ils examinaient, n’étaient pas suffisamment transparents ou cohérents. Une « vérification des faits » soi-disant objective était en réalité « sujette à l’appréciation d’un examinateur individuel », a-t-il ajouté. Les vérificateurs de faits passent souvent à côté d’histoires véritablement trompeuses, telles que des articles faisant état d’un risque relatif plutôt qu’un risque absolu, a déclaré Schwitzer.
Un problème plus vaste
Cochrane, le fournisseur international de revues systématiques de haute qualité des preuves médicales, a subi un traitement similaire de la part d’Instagram, qui, comme Facebook, appartient à la société mère Meta. Un porte-parole de Cochrane a déclaré qu’en octobre, son compte Instagram avait été rendu inaccessible (« shadowbanned ») pendant deux semaines, ce qui signifie que « lorsque d’autres utilisateurs ont essayé de se référer à Cochrane, un message apparaissait disant que @cochraneorg avait publié des éléments allant à l’encontre des directives de « faux contenu » (cf. fig. 1). L’inaccessibilité d’un compte peut conduire au masquage ou au cache de publications, de commentaires ou d’activités, et à la suppression de référencement dans les recherches.
Après avoir publié sur Instagram et Twitter à propos de l’interdiction, Cochrane a vu son service habituel finalement rétabli, sans avoir reçu la moindre explication motivant le fait qu’il aurait enfreint les directives antérieurement.
Le porte-parole a déclaré : « Nous pensons que Cochrane a été signalé car il avait publié une revue sur l’ivermectine et soutenait ironiquement une campagne sur la diffusion de fausses informations. Il semble parfois que l’automatisation et l’intelligence artificielle se trompent. Et les rapports d’utilisateurs et les mécanismes peuvent être utilisés pour bloquer les mauvaises personnes ».
En décembre, le BMJ a écrit une lettre ouverte à Mark Zuckerberg, directeur général de Meta. Dans cette lettre, les rédacteurs en chef Fiona Godlee et Kamran Abbasi ont qualifié la vérification des faits de Lead Stories d’« inexacte, incompétente et irresponsable ». Elle demandait à Meta de revoir l’avertissement placé sur l’article du BMJ et les processus qui ont conduit à son ajout, et de reconsidérer son approche globale de la vérification des faits.
Meta refuse d’intervenir
Meta a dirigé le BMJ vers sa page de conseils, qui indiquait que les éditeurs pouvaient faire appel d’une note directement auprès de l’organisme de vérification des faits concerné dans la semaine suivant sa notification. En déclarant : « Les vérificateurs de faits sont responsables de l’examen du contenu et de l’application des évaluations, et ce processus est indépendant de Meta ». Ce qui signifie que, comme dans le cas du BMJ, si l’organisme de vérification des faits refuse de modifier une note après l’appel d’un éditeur, l’éditeur a peu de recours.
L’absence d’une procédure d’appel indépendante suscite des inquiétudes, étant donné que les organisations de vérification des faits ont été accusées de partialité. « Je m’inquiète de la quantité de pouvoir placée entre les mains de ces groupes tiers », déclare Jillian York, directrice de la liberté d’expression internationale à l’Electronic Frontier Foundation, une organisation à but non lucratif qui promeut les libertés civiles dans le monde numérique. « Il n’y a pas de structure en responsabilité. Il n’y a pas de processus démocratique dans ce domaine. Et donc, même si je vois une importance dans la vérification des faits et que je pense que c’est bien supérieur à l’alternative – qui consiste simplement à supprimer du contenu de Facebook – je m’inquiète néanmoins toujours de l’effet potentiel sur des sources légitimes ».
En décembre, Lead Stories a écrit une réponse à la lettre ouverte du BMJ à Mark Zuckerberg qui suggérait que la lanceuse d’alerte Jackson n’était pas une source crédible. Elle exposait que Jackson n’était pas une « scientifique de laboratoire expérimentée » et que ses qualifications équivalaient à une « certification de 30 heures en techniques d’audit ». Or Jackson présente plus de 15 ans d’expérience dans la coordination et la conduite de recherches cliniques et a précédemment occupé un poste de directeur des opérations. « Je n’ai jamais prétendu être une scientifique », dit-elle. « Le cours de 30 heures n’est pas ce qui me qualifie. Toutes mes années à occuper différents rôles dans des essais cliniques sont ce qui me qualifie. De plus, un novice de la recherche clinique aurait remarqué ce qui se passait chez Ventavia. Il n’était pas nécessaire d’être un expert. »
Lead Stories a également critiqué le BMJ pour ne pas avoir inclus les « opinions publiquement exprimées de Jackson sur les vaccins covid ». Ceci en référence à des tweets qu’elle avait envoyés, tous après l’enquête du BMJ. L’un d’eux a critiqué un épisode de l’émission télévisée pour enfants Sesame Street dans lequel Big Bird se fait vacciner contre le covid, et un autre tweet exprimait son soutien à une décision d’un tribunal américain contre le fait de rendre la vaccination obligatoire pour les employés fédéraux. Lead Stories avait mis en exergue les mêmes tweets dans sa vérification des faits d’origine, affirmant que « sur Twitter, Jackson n’exprime pas de soutien sans réserve aux vaccins covid ». « Depuis quand est-ce l’obligation de tout citoyen de montrer un soutien sans réserve à quoi que ce soit ? » demanda Schwitzer. « C’est absolument sans rapport avec le sujet traité. Pour que ceci figure dans cet examen indépendant, je pense que cela en dit plus sur l’examinateur que sur l’évalué. »
Lead Stories adopte une position éditoriale sur la vaccination, dit York, qui fait écho à la propre position de Facebook. « Le problème plus vaste qui se pose est que des entreprises comme Facebook et certains des médias traditionnels sont habituellement préoccupés par la désinformation sur les vaccins, mais ont basculé si loin dans la direction opposée au point de censurer potentiellement les questions légitimes sur les grandes entreprises comme Pfizer », a-t-elle déclaré. L’industrie médicale a l’habitude de supprimer certaines informations, et les citoyens doivent pouvoir les remettre en question, a-t-elle ajouté.
Le 20 décembre, Lead Stories a également envoyé une série de tweets incendiaires après avoir publié sa réponse à la lettre ouverte du BMJ. Qui disait : « Hey @bmj_latest, quand vos articles sont littéralement republiés par un site Web géré par quelqu’un de la ‘Disinformation Dozen’ peut-être devriez-vous revoir vos politiques éditoriales au lieu d’écrire des lettres ouvertes ».
Le tweet comportait une photo de l’article du BMJ, qui avait été republié par Children’s Health Defense, un site Web antivaccin qui remet en question la sécurité des vaccins et finance des publicités antivaccinales sur Facebook. Lead Stories a également posé des questions concernant Paul Thacker, l’auteur de l’enquête du BMJ et cité comme tel dans l’article republié sur le site Web de Children’s Health Defense. Lead Stories a écrit via Twitter : « Est-ce que @thackerpd est vraiment d’accord pour être répertorié comme auteur sur childrenshealthdefense.org ? Ou s’y oppose-t-il ? La réponse en dira long. »
Thacker n’a pas écrit l’article pour Children’s Health Defense. Le site Web avait republié des articles du BMJ sans respecter les termes de sa licence. L’équipe juridique du BMJ a demandé à Children’s Health Defense de retirer les articles.
Contrôle des vérificateurs
La vérification des faits n’est pas une activité totalement non réglementée. L’IFCN a été créé en 2015 pour plaider « en faveur de normes plus élevées au sein de la communauté mondiale de la vérification des faits » (voir ici). Plus de 100 agences de vérification des faits du monde entier ont adhéré à la charte des principes de l’IFCN et sont contrôlées par celui-ci. Les signataires vont de ce que l’IFCN appelle les « grosses bêtes des médias traditionnels », comme Les Décodeurs du Monde en France et le Washington Post aux États-Unis, aux fils de presse mondiaux comme l’AFP, AP et Reuters, et des start-ups comme Rappler aux Philippines.
Le premier principe de la charte est un engagement à l’impartialité. Il dit : « Les signataires ne défendent pas ou ne prennent pas de positions politiques sur les questions qu’ils vérifient ». Le BMJ a déposé une plainte auprès du Poynter Institute, qui gère l’IFCN, alléguant que la conduite de Lead Stories ne respecte pas cet engagement et attend une réponse.
Le BMJ prévoit de faire appel au comité de surveillance de Facebook, un panel indépendant de 20 personnes du monde entier qui peut décider si Facebook doit autoriser ou supprimer un contenu spécifique. Il n’examine qu’un petit nombre de « cas emblématiques », notamment le maintien d’une décision prise le 7 janvier 2021 d’interdire au président américain de l’époque, Donald Trump, de publier sur Facebook et Instagram après la prise d’assaut du Capitole à Washington, DC, où cinq personnes sont décédées. Les décisions du comité sont contraignantes à moins que leur mise en œuvre ne viole la loi.
Carolina Are, chercheuse en modération en ligne et conférencière invitée à la City University de Londres, soutient les efforts du BMJ. « Le BMJ est une organisation de presse réputée qui dispose d’une énorme plate-forme et des moyens de contester ce genre de choses. Mais il existe une variété de créateurs sur les réseaux sociaux et en ligne en général qui voient simplement leur profil supprimé lorsque cela se produit », dit-elle. Pendant ce temps, les lecteurs rencontrent toujours des problèmes pour partager l’enquête du BMJ sur Facebook.
Kamran Abbasi, rédacteur en chef du BMJ, a déclaré : « Nous devrions tous être très inquiets que Facebook, une entreprise multimilliardaire, censure effectivement un journalisme complètement vérifié qui soulève des inquiétudes légitimes quant à la conduite d’essais cliniques. Les actions de Facebook n’empêcheront pas le BMJ de faire ce qui est juste, mais la vraie question est : pourquoi Facebook agit-il ainsi ? Qu’est-ce qui motive sa vision du monde ? Est-ce une idéologie ? S’agit-il d’intérêts commerciaux ? Est-ce de l’incompétence ? Les utilisateurs devraient s’inquiéter du fait que, bien qu’il se présente comme une plate-forme de média social neutre, Facebook essaie de contrôler la façon dont les gens pensent sous couvert de « vérification des faits » ».