Nous avons deux découvertes importantes à partager aujourd’hui sur les solutions nutritionnelles potentielles contre la coagulation et les protéines de pointe. Premièrement, une étude publiée en 2021 est soudainement devenue virale au cours des deux derniers jours, lorsque quelqu’un s’est rendu compte qu’elle montrait comment la combinaison de bromélaïne et d’acétylcystéine, communes dans l’industrie des suppléments, peut inactiver la protéine de pointe en modifiant sa morphologie, la rendant incapable de s’attaquer aux cellules.
L’étude s’intitule : « La combinaison de bromélaïne et d’acétylcystéine (BromAc) inactive de manière synergique le SRAS-CoV-2 ».
Il a été publié dans la revue Viruses et apparaît sur Researchgate.net ainsi que sur d’autres plateformes d’indexation d’articles scientifiques. Le texte intégral de l’article est mis gratuitement à la disposition du public.
Rédigée par un groupe de chercheurs – avec Ahmed Mekkawy le chercheur principal – l’étude a examiné comment la bromélaïne et l’acétylcystéine – également connue sous le nom de supplément NAC – modifient les glycoprotéines de la protéine de pointe. Le tableau suivant montre les changements dans l’opacité des cultures de cellules SARS-CoC-2 lors de l’exposition à différentes concentrations de la combinaison nutritionnelle BromAc : (notez que les microgrammes par ml signifie ppm, donc ce sont des concentrations assez faibles mais qui ont toujours un impact mesurable) :
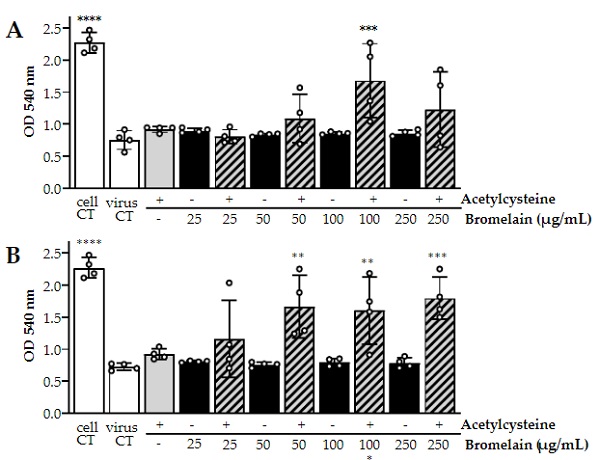
Figure 2. Les tests de lyse cellulaire ont démontré le potentiel d’inactivation in vitro de l’acétylcystéine et de bromelaïne combinés (BromAc) contre le SRAS-CoV-2. La viabilité cellulaire a été mesurée par coloration cellulaire avec du rouge neutre, où la densité optique (DO) est directement proportionnelle aux cellules viables. Une faible DO signifierait une lyse cellulaire importante due à la réplication du virus.
La conclusion de l’étude explique comment cette combinaison de bromélaïne et d’acétylcystéine modifie la structure des glycoprotéines du SRAS-CoC-2, les rendant incapables d’attaquer les cellules humaines :
La combinaison de bromélaïne et d’acétylcystéine, BromAc, a inhibé de manière synergique l’infectivité de deux souches de SRAS-CoV-2 cultivées sur des cellules Vitro. La confirmation de la protéine et ses propriétés moléculaires dépendent de son intégrité structurale et géométrique, qui dépendent à la fois des liaisons peptidiques et des ponts disulfure. L’acétylcystéine, en tant que bon agent réducteur, a tendance à réduire les ponts disulfure et donc à modifier les propriétés moléculaires de la plupart des protéines. Cette propriété a été largement exploitée dans le développement de plusieurs thérapeutiques (bronchopneumopathie chronique obstructive, maladies respiratoires allergiques, fibrose kystique, pseudomyxome péritonéal…) [20,23–27]. Plus récemment, l’acétylcystéine a été utilisée dans le développement de thérapies pour les infections respiratoires telles que la grippe et le COVID-19 [28–30], où l’intégrité de la protéine de pointe est vitale pour l’infection [12,13]. Un mécanisme d’action hypothétique pourrait être le déploiement de la glycoprotéine de pointe et la réduction de ses liaisons disulfure.
Une action mécanique directe contre cette protéine de pointe est une stratégie de traitement différente par rapport à la plupart des médicaments antiviraux existants, qui empêche l’entrée virale dans les cellules hôtes plutôt que de cibler la machinerie de réplication. BromAc agit comme un agent biochimique pour détruire les glycoprotéines complexes. Les compétences enzymatiques multipotentes de la bromélaïne, dominées par la capacité de perturber les liaisons glycosidiques, complètent utilement le fort pouvoir de l’acétylcystéine pour réduire la liaison disulfure. Le potentiel de BromAc sur les protéines de pointe et d’enveloppe du SRAS-CoV-2 stabilisées par des liaisons disulfure a été examiné et s’est avéré induire le déploiement de protéines recombinantes de pointe et d’enveloppe en réduisant les ponts stabilisateurs disulfure. BromAc a également montré un effet inhibiteur sur le SRAS-CoV-2 de type sauvage et mutant de pointe par inactivation de sa capacité de réplication in vitro. Par conséquent, BromAc peut être un agent thérapeutique efficace pour l’infection précoce par le SRAS-CoV-2, malgré les mutations, et a même un potentiel prophylactique chez les personnes à haut risque d’infection.
Il est important de noter que ces tests ont été effectués in vitro et qu’à ma connaissance, il n’y a eu aucun essai clinique sur l’homme sur cette combinaison, car le NIH ne financerait jamais rien d’autre que la recherche sur les médicaments et les vaccins de Big Pharma. Considérez les informations présentées ici comme une action d’itinéraire théorique qui mérite une exploration plus approfondie.
Néanmoins, étant donné que la bromélaïne et l’acétylcystéine sont largement consommées en tant que suppléments nutritionnels à l’heure actuelle – et sont facilement disponibles et abordables – ces solutions méritent d’être considérées comme des interventions à faible coût et à faible risque qui peuvent s’avérer utiles pour sauver des vies.
Source :